
 “盐水动力”玩具车的电池以镁片、活性炭为电极,向极板上滴加食盐水后电池便可工作,电池反应为2Mg+O2+2H2O=2Mg(OH)2.下列关于该电池的说法错误的是( )
“盐水动力”玩具车的电池以镁片、活性炭为电极,向极板上滴加食盐水后电池便可工作,电池反应为2Mg+O2+2H2O=2Mg(OH)2.下列关于该电池的说法错误的是( )| A. | 镁片作为正极 | |
| B. | 食盐水作为电解质溶液 | |
| C. | 电池工作时镁片逐渐被消耗 | |
| D. | 电池工作时实现了化学能向电能的转化 |
分析 该装置是将化学能转化为电能的装置,Mg易失电子作负极、C作正极,负极反应式为Mg-2e-+2OH-=Mg(OH)2↓、正极反应式为 O2+4e-+2H2O=4OH-,据此分析解答.
解答 解:A.根据原电池反应式知,Mg元素化合价由0价变为+2价,所以Mg失电子作负极,故A错误;
B.电解质溶液是食盐水,发生吸氧腐蚀,故B正确;
C.Mg作负极,电极反应式为Mg-2e-+2OH-=Mg(OH)2↓,所以电池工作时镁片逐渐被消耗,故C正确;
D.该装置是将化学能转化为电能的装置,为原电池,故D正确;
故选A.
点评 本题考查化学电源新型电池,为高频考点,明确正负极的判断、原电池原理即可解答,难点是电极反应式的书写,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 离子化合物只能由金属元素和非金属元素组成 | |
| B. | 离子化合物只能存在离子键 | |
| C. | HCl能电离出氢离子和氯离子,所以HCl存在离子键 | |
| D. | 共价化合物中不可能存在离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 阿司匹林(又称乙酰水杨酸,
阿司匹林(又称乙酰水杨酸, 是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128-135℃.某学习小组在实驻室以水杨酸(邻羟基苯甲酸)与乙酸酐[(CH3CO)2O]为主要原料合成阿司匹林,其制备原理为:
是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128-135℃.某学习小组在实驻室以水杨酸(邻羟基苯甲酸)与乙酸酐[(CH3CO)2O]为主要原料合成阿司匹林,其制备原理为: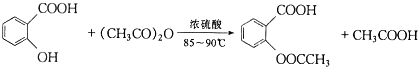
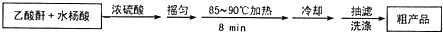

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ),其原理如图1所示.
),其原理如图1所示.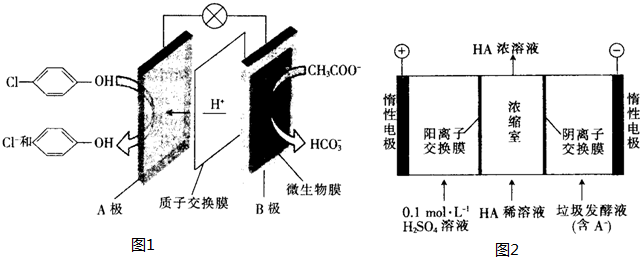
 -OH+2e-+H+═
-OH+2e-+H+═ -OH+Cl-.
-OH+Cl-.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度能加快反应速率 | B. | 使用恰当的催化剂能加快反应速率 | ||
| C. | 增大O2的浓度能加快反应速率 | D. | SO2与O2能100%转化为SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
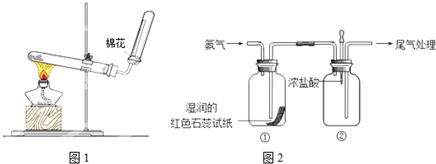
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A |  ①由C、H、O三种元素组成 ②球棍模型为: ③能与NH3在一定条件下反应生成丙烯酰胺CH2=CHCONH2 ④相对分子质量为72 |
| B | ①由C、H、O三种元素组成 ②能与Na反应,但不能与NaOH溶液反应 ③能与A反应生成相对分子质量为100的酯 |
| C | ①相对分子质量与B相同 ②能被新制的氢氧化铜悬浊液氧化 ③能与NaHCO3溶液反应放出CO2气体 |
| D | ①能使溴的四氯化碳溶液褪色 ②能与水在一定条件下反应生成B |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
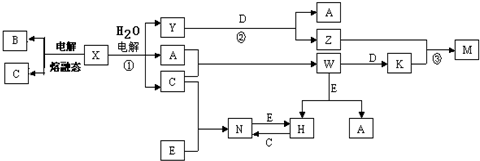
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com