
某学生以铁丝和Cl2为原料进行下列三个实验。
从分类角度下列分析正确的是
A.实验①、③反应制得的物质均为纯净物
B.实验②、③均未发生氧化还原反应
C.实验②、③均为放热反应
D.实验①、②所涉及的物质均为电解质或非电解质
 口算能手系列答案
口算能手系列答案科目:高中化学 来源:2014-2015学年四川省绵阳市高三第三次诊断性考试理综化学试卷(解析版) 题型:填空题
X、Y、Z、R为短周期元素且原子序数依次增大。X、R原子核外电子层数等于其最外层电子数,Y元素的基态原子中电子分布在3个不同的能级,且每个能级中的电子总数相同;Z 的两种同素异形体都存在于大气中,对生命起着重要作用。另有M元素位于周期表的第4周期第6列。请回答下列问题:
(1)上述5种元素中,电负性最大的是(填名称)_____,X3Z+的VSEPR模型名称是______。
(2)M基态原子的电子排布式是______________。
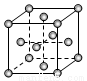
(3)R的单质为面心立方最密堆积(见图),则一个晶胞中R原子数为 ,R的配位数是 。
(4)已知:M2Z3与R2Z3结构和性质相似,则M2Z3溶于强碱时发生反应的离子方程式是_________________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市闵行区高三下学期质量调研考试(二模)化学试卷(解析版) 题型:选择题
下图可设计成多种用途的电化学装置。下列分析正确的是

A.当a和b用导线连接时,溶液中的SO42-向铜片附近移动
B.将a与电源正极相连可以保护锌片,这叫牺牲阳极的阴极保护法
C.当a和b用导线连接时,铜片上发生的反应为:2H++2e →H2↑
D.a和b用导线连接后,电路中通过0.02mol电子时,产生0.02mol气体
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江西省鹰潭市高三第二次模拟考试理综化学试卷(解析版) 题型:选择题
下列说法不正确的是
A.H2O在高温下难分解,而H2S在300℃时就分解,说明O非金属性比S强。
B.H2CO3的酸性比HClO的酸性强,所以C的非金属性比Cl强。
C.NaOH的碱性比Mg(OH)2的碱性强, 所以Na的金属性比Mg强。
D.Fe3+的氧化性比Cu2+的氧化性强,但Fe的金属性比Cu强。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江西省景德镇市高三下学期第三次质检考试理综化学试卷(解析版) 题型:简答题
(15分)(NH4)2Fe(SO4)2俗称莫尔盐,其常见的制备工艺流程如下:
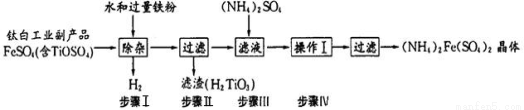
(1)已知流程中铁粉制备反应如下:
4 H2O(g) +3Fe(s) Fe3O4(s)十4H2(g) △H =a kJ /mol
Fe3O4(s)十4H2(g) △H =a kJ /mol
Fe3O4(s) = 3 Fe(s)+ 2O2(g) △H =b kJ/mol
则光解气态水制备H2的热化学方程式为 。
(2)步骤I中加水发生如下反应,请完善该反应: +2H2O  2H++ H2TiO3 ↓;
2H++ H2TiO3 ↓;
该步骤加入铁粉的作用是① ;② 。
(3)步骤Ⅳ生成(NH4)2Fe(SO4)2,其化学反应方程式为 ;
写出(NH4)2Fe(SO4)2溶液中各离子溶度由大到小的顺序:
(4)已知在潮湿空气中Fe(OH)2比FeCl2更易被氧化。据此分析(NH4)2Fe(SO4)2比FeSO4稳定的原因是 。
(5)室温时Fe(OH)3的悬浊液中存在Fe(OH)3(s) Fe3+(aq)+3OH-(aq) Ksp[Fe(OH)3] =8ⅹ10-32若此悬浊液中 c(Fe3+)=0.08 mol·L-1则溶液的pH等于 。
Fe3+(aq)+3OH-(aq) Ksp[Fe(OH)3] =8ⅹ10-32若此悬浊液中 c(Fe3+)=0.08 mol·L-1则溶液的pH等于 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省岳阳市高三质量检测(二)理综化学试卷(解析版) 题型:填空题
【化学—选修3:物质结构与性质】(15分)已知位于元素周期表前四周期的六种元素A、B、C、D、E、F的原子序数之和为107,且它们的核电荷数依次增大。B原子的p轨道半充满,其氢化物沸点是同族元素中最低的,D原子得到一个电子后3p轨道全充满,A与C能形成A2C型离子化和物,其中的阴、阳离子相差一个电子层,E4+离子和氩原子的核外电子排布相同。请回答下列问题:
(1)A、B、C、D的第一电离能由小到大的顺序是____________(填元素符号)
(2)化合物BD3的分子空间构型可描述为_________,B的原子轨道杂化类型为_______。
(3)已知F元素在人体内含量偏低时,会影响O2在体内的正常运输。已知F2+与KCN溶液反应得F(CN)2沉淀,当加入过量KCN溶液时沉淀溶解,生成配合物。则F的基态原子价电子排布式为________________。CN-与___________(一种分子)互为等电子体,则1个CN-中π键数目为___________。
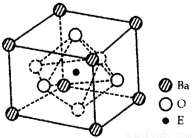
(4)EO2与碳酸钡在熔融状态下反应,所得晶体的晶胞结构如图所示,则该反应的化学方程式为__________
在该晶体中,E4+的氧配为数为___________。若该晶胞边长为a nm可计算该晶体的密度为__________g/cm3(阿伏加德罗常数为NA)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省岳阳市高三质量检测(二)理综化学试卷(解析版) 题型:选择题
下图为某化学课外学习小组设计的电解饱和食盐水的简易装置。下列有关说法正确的是

A.电解一段时间后,往蛋壳中溶液中滴加几滴酚酞,呈红色
B.蛋壳表面缠绕的铁丝发生氧化反应
C.铁丝表面生成的气体能使湿润的淀粉碘化钾试纸变蓝
D.蛋壳可阻止生成的氯气与氢气、氢氧化钠溶液接触
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省怀化市高三学业水平模拟考试化学试卷(解析版) 题型:选择题
浓硫酸不具有的性质是
A.吸水性 B.腐蚀性 C.强氧化性 D.易挥发性
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东高考佛山市高三二模理综化学试卷(解析版) 题型:实验题
地下水中硝酸盐造成的氮污染已成为一个世界性的环境问题,某课题组利用Fe粉和酸性KNO3溶液反应模拟地下水脱氮过程,理想的脱氮原理为:4Fe + NO3- + 10H+ = 4Fe2+ + NH4+ + 3H2O。
(1)研究发现:随着KNO3溶液酸性的减弱,对应还原产物中氮元素的化合价越低。课题组用酸性弱的KNO3溶液进行实验,没有观察到气体生成,则该条件下KNO3的还原产物可能是 (化学式)。
(2)实验发现:反应一段时间后,反应体系中NH4+的浓度在增大,Fe2+的浓度却没有增大,可能的原因是 。
a.生成的Fe2+水解 b.Fe2+被氧化生成Fe3+ c.Fe2+被还原成Fe
(3)该课题组拟利用上述脱氮反应研究不同自变量对反应速率的影响。
可能用到的试剂和仪器:粗颗粒Fe粉、细颗粒Fe粉、2.0mol/L KNO3、0.1 mol/L H2SO4、蒸馏水、不同温度的恒温水浴、托盘天平、秒表、离子色谱仪等。
①设计实验方案:在不同的自变量(温度、铁粉颗粒的大小)时,测定 (要求所测得的数据能直接体现反应速率大小)。
②参照下表格式,拟定实验表格,完整体现实验方案(列出所选试剂体积、需记录的待测物理量和所拟定的数据:数据用字母表示)。
【提示】离子色谱仪能跟踪测定溶液中的c(NO3-)
物理量 实验序号 | V(2.0mol/L KNO3)/ mL | …… | |
1 | a | …… | |
2 | a | …… | |
3 | a | …… |
③进一步的研究表明:将铁粉和活性炭同时加入上述KNO3溶液中,可以明显提高脱氮速率,其原因是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com