
分析 (1)N2和NO的质量比为14:15,令N2和NO的总质量分别为28g、30g,根据n=$\frac{m}{M}$计算各自物质的量,计算N原子、O原子物质的量,进而计算N、O原子数目之比,再根据M=$\frac{{m}_{总}}{{n}_{总}}$计算平均摩尔质量;
(2)设质量为1g,根据n=$\frac{m}{M}$计算各气体物质的量,气体体积之比等于物质的量之比;计算各物质含有原子物质的量,比较原子大小;相同条件下,气体密度之比等于相对分子质量;
(3)根据n=计算$\frac{V}{4}$mL Al2(SO4)3溶液中铝离子的质量,再根据n=$\frac{m}{M}$计计算$\frac{V}{4}$L Al2(SO4)3溶液Al3+的物质的量,由化学式中离子的关系可确定$\frac{V}{4}$mL Al2(SO4)3溶液SO42-的物质的量,然后利用c=$\frac{n}{V}$来计算稀释到V mL 溶液中SO42-的物质的量浓度;
(4)根据气体的体积计算气体的物质的量,进而计算气体的质量,根据气体的质量和溶液的总质量计算溶液的质量分数,根据气体的物质的量和溶液的体积计算物质的量浓度;
(5)根据该强碱的摩尔质量计算出mg M(OH)2的物质的量,再计算出氢氧根离子的物质的量及物质的量浓度;
根据溶液的体积和密度计算出溶液的质量,根据溶质的质量分数表达式计算出所得溶液中溶质的质量分数;
根据溶解度计算公式计算出此温度下该碱的溶解度.
解答 解:(1)N2和NO的质量比为14:15,令N2和NO的总质量分别为28g、30g,则N2为1mol、NO为1mol,合气体中N2和NO的物质的量之比为1:1,混合气体中氮原子和氧原子的个数比为(2mol+1mol):1mol=3:1,该混合气体的平均摩尔质量为:$\frac{28g+30g}{1mol+1mol}$=29g/mol,
故答案为:1:1;3:1;29g/mol;
(2)设质量为1g,则:
①CO2物质的量=$\frac{1g}{44g/mol}$=$\frac{1}{44}$mol,含有原子为$\frac{1}{44}$mol×3=0.068mol,相对分子质量为44;
②H2物质的量=$\frac{1g}{2g/mol}$=0.5mol,含有原子为0.5mol×2=1mol,相对分子质量为2;
③O2物质的量=$\frac{1}{32}$mol,含有原子为$\frac{1}{32}$mol×2=$\frac{1}{16}$mol=0.0625mol,相对分子质量为32;
④CH4物质的量=$\frac{1}{16}$mol,含有原子为$\frac{1}{16}$mol×4=0.25mol,相对分子质量为16;
⑤SO2物质的量=$\frac{1}{64}$mol,含有原子为$\frac{1}{64}$mol×3=0.0469mol,相对分子质量为64;
气体体积之比等于物质的量之比,故体积:②>④>③>①>⑤;
含有原子大小顺序为:②>④>①>③>⑤;
相同条件下,气体密度之比等于相对分子质量,故密度:⑤>①>③>④>②,
故答案为:②>④>③>①>⑤;②>④>①>③>⑤;⑤>①>③>④>②;
(3)V mL Al2(SO4)3溶液中含有Al3+a g,则$\frac{V}{4}$mL Al2(SO4)3溶液中铝离子的质量为$\frac{V}{4}$ag;
所以$\frac{V}{4}$ mLAl2(SO4)3溶液Al3+的物质的量为:$\frac{\frac{1}{4}ag}{27g/mol}$=$\frac{a}{108}$mol,
所以$\frac{1}{4}$V mLAl2(SO4)3溶液SO42-的物质的量=$\frac{a}{108}$mol×$\frac{3}{2}$=$\frac{a}{72}$mol,
所以稀释到V mL,溶液中SO42-的物质的量浓度为:$\frac{\frac{a}{72}mol}{V×1{0}^{-3}L}$=$\frac{125a}{9V}$mol/L,
故答案为:$\frac{125a}{9V}$mol/L;
(4)标准状况下将224LHCl的物质的量为:n(HCl)=$\frac{224L}{22.4L/mol}$=10mol,则m(HCl)=10mol×36.5g/mol=365g,
溶液的质量为:365g+1000g=1365g,
所以溶液的质量分数为:$\frac{365g}{1365g}$×100%=26.74%,
溶液的体积为:$\frac{1365g}{1.1g/ml}$=1240.9ml,即1.2409L,
所以,溶液的物质的量浓度为$\frac{10mol}{1.2409L}$=8.06mol/L,
故答案为:26.74%,8.06mol/L;
(5)M(OH)2的摩尔质量为Mg/mol,mg该强碱的物质的量为:$\frac{mg}{Mg/mol}$=$\frac{m}{M}$mol,含有氢氧根离子的物质的量为2×$\frac{m}{M}$mol,溶液中氢氧根离子的物质的量浓度为:$\frac{\frac{2m}{M}mol}{V×1{0}^{-3}L}$=$\frac{2000m}{MV}$mol/L;
配制的溶液的质量为:ρg/cm3×VmL=ρVg,溶质的质量分数为:$\frac{m}{ρV}$×100%=$\frac{100m}{ρV}$%,
此温度下该碱的溶解度为:S=$\frac{{m}_{溶质}}{{m}_{溶剂}}$×100g=$\frac{m}{ρV-m}$×100g=$\frac{100m}{ρV-m}$g,
故答案为:$\frac{2000m}{MV}$mol/L;$\frac{100m}{ρV}$%; $\frac{100m}{ρV-m}$g.
点评 本题考查阿伏伽德罗定律及其推论、化学综合计算,题目难度较大,试题计算量较大、涉及比较综合,注意物质的量与质量、体积、粒子数目、浓度的计算公式的运用.


 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 氰分子中四原子共直线,是非极性分子 | |
| B. | 氰分子中N的杂化类型为SP | |
| C. | 氰气分子中含有σ键和π键 | |
| D. | 氰分子中C≡N键长大于C≡C键长 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 熔点/℃ | 沸点/℃ | 燃烧热/kJ•mol-1 | |
| 铝 | 660 | 2467 | 602 |
| 氧化铝 | 2050 | 2980 | / |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 银镜反应采用水浴加热 | |
| B. | 用通过盛溴水的洗气瓶的方法除去甲烷气体中含有的乙烯杂质 | |
| C. | 在乙醛还原新制Cu(OH)2悬浊液的实验中,制Cu(OH)2悬浊液时应保持NaOH过量,可直接加热 | |
| D. | 配制银氨溶液时,将AgNO3溶液滴入氨水中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ),并且乙烯基和次甲基之间必须通过亚甲基相连,当该烃含有单环结构是分子中的乙烯基和亚甲基的个数依次为( )
),并且乙烯基和次甲基之间必须通过亚甲基相连,当该烃含有单环结构是分子中的乙烯基和亚甲基的个数依次为( )| A. | 2个,3个 | B. | 5个,3个 | C. | 4个,6个 | D. | 3个,6个 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
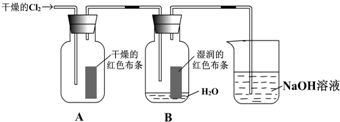
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 )是一种镇痛和麻醉药物,可由化合物B(
)是一种镇痛和麻醉药物,可由化合物B( )通过以下路线合成得到.
)通过以下路线合成得到.
 .
. +HBr+CH3Br.
+HBr+CH3Br. 等.
等. 所示)的合成路线流程图(无机试剂任选).
所示)的合成路线流程图(无机试剂任选).
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由${\;}_{1}^{2}$H和${\;}_{8}^{18}$O所组成的11g水中所含中子数为6NA | |
| B. | H2O和D2O互称为同素异形体,且两者的化学性质相似 | |
| C. | ${\;}_{8}^{18}$O2和${\;}_{8}^{16}$O3互称为同位素 | |
| D. | 金刚石和石墨互为同素异形体,两者之间的转化属于物理变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
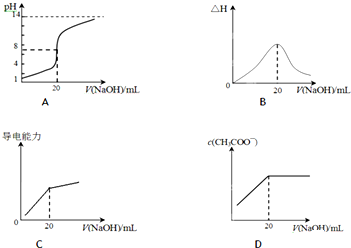 Ⅰ.常温下,某水溶液中只存在下列四种离子:Na+、A-、H+、OH-,据题意回答下列问题.
Ⅰ.常温下,某水溶液中只存在下列四种离子:Na+、A-、H+、OH-,据题意回答下列问题.| 酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) |
| CH3COOH | 1.8×10-5 | HCN | 5×10-10 |
| H2CO3 | Ka1=4.2×10-7 | HClO | 3×10-8 |
| Ka2=5.6×10-11 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com