
【题目】最近有科学家提出“绿色自由”的构想:把含有CO2的空气吹入K2CO3溶液中,然后再用高温水气分解出CO2,经与H2化合后转变为甲醇燃料.
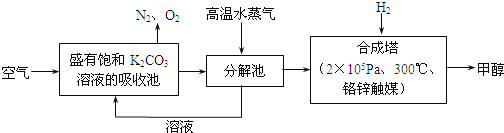
(1)在整个生产过程中饱和K2CO3溶液的作用是_______;不用KOH溶液的理由是_________。
(2)在合成塔中,每44g CO2与足量H2完全反应生成甲醇时,可放出49.5kJ的热量,试写出合成塔中发生反应的热化学方程式_______________;转化过程中可循环利用的物质除了K2CO3外,还有___________。
(3)请评述合成时选择2×105Pa的理由_____________________________________。
(4)BaCO3的溶解平衡可以表示为 BaCO3(s)Ba2++CO32﹣
①写出平衡常数表达式___________________;
②用重量法测定空气中CO2的体积分数时,选用Ba(OH)2而不是Ca(OH)2为沉淀剂,原因之一是:25℃时,BaCO3的溶解平衡常数K=2.58×10﹣9,而CaCO3的溶解平衡常数K=4.96×10﹣9;原因之二是_________________________。
(5)某同学很快就判断出以下中长石风化的离子方程式未配平:
4Na0.5Ca0.5Al1.5Si2.5O6+6CO2+17H2O=2Na++2Ca2++5HCO3﹣+4H4SiO4+3Al2SiO5(OH)4
该同学判断的角度是______________。
(6)甲醇可制成新型燃料电池,总反应为:2CH3OH+3O2+4KOH=2K2CO3+6H2O该电池负极的电极反应式为:CH3OH﹣6e+8OH﹣=CO32﹣+6H2O则正极的电极反应式为:______________。
【答案】富集CO2 生成的K2CO3难分解产生CO2 CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H=﹣49.5kJ/mol 水蒸气 适当加压有利于提高反应速率和原料利用率,但压强太高增大成本 K= c(Ba2+)c(CO32﹣) BaCO3的式量大,相对误差小 未配平两边电荷数 O2+2H2O+4e-=4 OH﹣
【解析】
(1)碳酸氢钾不稳定,加热时分解生成碳酸钾和二氧化碳、水,碳酸钾不分解;
(2)4.4kgCO2的物质的量是100mol,100mol二氧化碳和足量氢气反应放出4947KJ热量,据此计算1mol二氧化碳与足量氢气反应放出的热量,从而写出其热化学反应方程式;根据合成甲醇的方程可知,反应生成甲醇和水蒸气,水蒸气可以给碳酸氢钾分解提供能量;
(3)合成甲醇的反应为体积减小的反应,增大压强平衡正移;
(4)①溶解平衡方程式书写平衡常数表达式;
②重量法测定空气中CO2的体积分数,要求称量准确,误差小;
(5)书写离子方程式要注意原子守恒和电荷守恒;
(6)碱性甲醇燃料电池中,甲醇在负极失电子,氧气在正极得电子。
(1)在整个生产过程中饱和K2CO3溶液的作用是富集二氧化碳,二氧化碳和饱和的碳酸钾溶液反应生成碳酸氢钾,碳酸氢钾不稳定,加热时分解生成碳酸钾、二氧化碳和水,KOH溶液与二氧化碳是碳酸钾,K2CO3难分解产生CO2;
(2)44gCO2的物质的量是1mol,1mol二氧化碳和足量氢气反应放出49.5kJ热量,所以其热化学反应方程式为:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H=﹣49.5kJ/mol;根据合成甲醇的方程可知,反应生成甲醇和水蒸气,水蒸气可以给碳酸氢钾分解提供能量,所以转化过程中可循环利用的物质除了K2CO3外,还有水蒸气;
(3)合成甲醇的反应为体积减小的反应,增大压强平衡正移,有利于提高反应速率和原料利用率,但是压强太高对反应的设备要求很高,又提高了生产成本,所以不能太高;
4)①BaCO3的溶解平衡可以表示为 BaCO3(s)Ba2++CO32﹣,平衡常数表达式为K= c(Ba2+)c(CO32﹣);
②重量法测定空气中CO2的体积分数,要求称量准确,误差小,BaCO3的式量大,称量的相对误差小;
(5)书写离子方程式要注意原子守恒和电荷守恒,4Na0.5Ca0.5Al1.5Si2.5O6+6CO2+17H2O=2Na++2Ca2++5HCO3﹣+4H4SiO4+3Al2SiO5(OH)4中电荷不守恒,原子个数也不守恒,所以离子方程式错误;
(6)碱性甲醇燃料电池中,甲醇在负极失电子,氧气在正极得电子生成氢氧根离子,则正极反应式为:O2+2H2O+4e-=4OH﹣。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式如下:2NO+2CO![]() 2CO2+N2。为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
2CO2+N2。为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/(10-4mol·L-1) | 10 | 4.5 | 2.5 | 1.5 | 1.0 | 1.0 |
c(CO)/(10-3mol·L-1) | 36.0 | 30.5 | 28.5 | 27.5 | 27.0 | 27.0 |
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1) 已知该反应ΔS<0,在上述条件下反应能够自发进行,则反应的ΔH________0(填写“>”“<”或“=”)。
(2)前2 s内的平均反应速率v(N2)=________。
(3)在该温度下,反应的平衡常数表达式K=________。
(4)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是________。
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前海水提溴的最主要方法之一是空气吹出法,其部分流程图如下:
![]()
以下推断不合理的是( )
A. 热空气能吹出溴是利用溴易挥发的性质
B. SO2吸收溴的反应方程式:SO2+2H2O+Br2=H2SO4+2HBr
C. 流程中循环利用的物质有SO2、Br2、Cl2等
D. 没有采用直接蒸馏含Br2的海水得到单质溴主要是为了节能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧化镁:①是中强碱;②广泛用作阻燃剂和填充剂.以白云石(化学式:MgCO3CaCO3)为原料制备氢氧化镁的工艺流程如下:
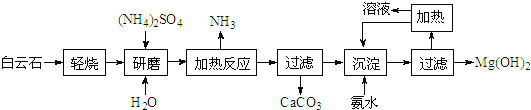
(1)根据流程图,白云石“轻烧”后固体产物的主要成份是MgO和_______(写化学式)。
(2)流程图中“加热反应”有氨气生成的化学方程式为_________________________。
(3)洗涤Mg(OH)2沉淀所用玻璃仪器有:_______、烧杯、玻棒;检验洗净的方法是____________。
(4)传统工艺是将白云石高温分解为氧化镁和氧化钙后提取,而该工艺采用轻烧白云石的方法,其优点是__________________。
(5)25℃时Mg(OH)2饱和溶液的中:c(Mg2+)=2.80×10﹣4mol/L,Mg(O2)22﹣、Mg(OH)42﹣的浓度共为2.35×10﹣4mol/L,则溶液的pH=_______(取整数值);若经过循环利用,每制得5.8t Mg(OH)2时排出200m3的废水,其中Mg2+、Mg(O2)22﹣、Mg(OH)42﹣的浓度共为1.50×10﹣4mol/L,则该工艺的产率为___________(保留4位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有1950g发烟硫酸(用aSO3H2O表示),SO3和H2SO4的质量分数分别为0.3和0.7,加bg水稀释成某浓度的硫酸(用H2SO4H2O表示),则以下正确的是( )(允许最后一位数字不同)
A.a=1.38B.a=1.53C.b=174D.b=165
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国是镁资源最为丰富的国家之一.
(1)将1mol镁铝合金(Mg17Al12)完全溶解于12L 6mol/L的盐酸中,放出氢气______mol,为使反应后溶液中的Mg2+、Al3+完全沉淀,需加入10mol/L的氨水至少______L。
(2)灼烧碱式碳酸镁可得到MgO.取碱式碳酸镁4.66g,灼烧至恒重,得到2g固体和1.76g CO2,某学生为确定碱式碳酸镁的化学式列了以下联立方程:
24+17x+60y+18z=4.66÷(![]() )…①
)…①
2﹣x﹣2y=0…②
(![]() )×(0.5x+z)×18=4.66﹣2﹣1.76…③
)×(0.5x+z)×18=4.66﹣2﹣1.76…③
(a)①式表达的是求算碱式碳酸镁摩尔质量的关系式,则②式表达的是_______________;
(b)以上关系式是正确的,据此可求出该碱式碳酸镁的化学式为________________________________。
(3)氧化镁可用于烟气脱硫,反应原理为:
MgO+H2O=Mg(OH)2 Mg(OH)2+SO2=MgSO3+H2O
MgSO3+H2O+SO2=Mg(HSO3)2 2MgSO3+O2=2MgSO4
某小组模拟脱硫过程如下(实验在25℃进行):将MgO加入水中,不断搅拌,通入SO2和空气,得到550g滤液和若干克滤渣.取55g滤液依次加入足量的盐酸和BaCl2溶液,得到0.897g白色沉淀;另取55g滤液加入足量氯水和BaCl2混合溶液,得到1.992g白色沉淀.分析知滤渣中含MgSO3 16.82g(其它成分不含硫元素)。
①该实验过程中吸收的SO2的物质的量为________mol;消耗氧气的物质的量为_______mol。
②Mg(HSO3)2易溶于水;25℃溶解度,MgSO4:33.7g/100g水;MgSO3:0.652g/100g水.试通过计算确定550g滤液中镁盐的成分及物质的量(写出计算过程)___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成有机溶剂M和高分子材料N的路线如图:
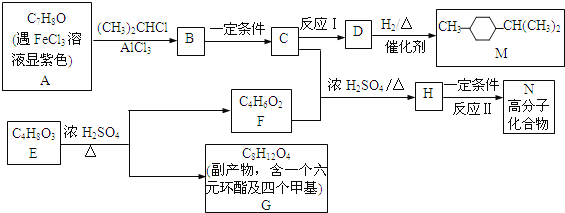
己知:芳香族化合物苯环上的氢原子可被卤代烷中的烷基取代.如:
![]()
(1)写出反应类型.反应Ⅰ__________ 反应Ⅱ____________。
(2)写出D的分子式___________。写出G的结构简式_____________。
(3)写出E生成F的化学反应方程式______________________________。
(4)E在浓硫酸作用下转化为F时,除生成副产物G,还会生成高分子副产物,写出该副产物的结构简式____________________________。
(5)属于酯类且含甲基F的同分异构体有多种,写出其中一种的结构简式______________。
(6)写出高分子化合物N的结构简式_________________(任写一种)。A有2种结构,可通过定量实验来确定其准确结构,该定量实验可通过A与__________(填写物质名称)反应来实现。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】100℃时,将0.1 mol N2O4置于1 L密闭的烧瓶中,然后将烧瓶放入100℃的恒温槽中,烧瓶内的气体逐渐变为红棕色:N2O4(g) ![]() 2NO2 (g)。下列结论不能说明上述反应在该条件下已经达到反应限度的是( )
2NO2 (g)。下列结论不能说明上述反应在该条件下已经达到反应限度的是( )
①N2O4的消耗速率与NO2的生成速率之比为1∶2;②NO2的生成速率与NO2消耗速率相等;③烧瓶内气体的压强不再变化;④烧瓶内气体的质量不再变化;⑤NO2的物质的量浓度不再改变;⑥烧瓶内气体的颜色不再加深;⑦烧瓶内气体的平均相对分子质量不再变化;⑧烧瓶内气体的密度不再变化。
A. ②③⑥⑦ B. ①④⑧
C. 只有①④ D. 只有⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应
X(g)+Y(g) ![]() 2Z(g) △H < 0,一段时间后达到平衡,反应过程中测定的数据如下表:
2Z(g) △H < 0,一段时间后达到平衡,反应过程中测定的数据如下表:
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法正确的是
A.反应前2min的平均速率ν(Z)=2.0×10-3mol·L-1·min-1
B.其他条件不变,降低温度,反应达到新平衡前ν(逆)> ν(正)
C.该温度下此反应的平衡常数K=1.44
D. 其他条件不变,再充入0.2molZ,平衡时X的体积分数增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com