
下列关于氯的说法正确的是 ( )。
A.Cl2具有很强的氧化性,在化学反应中只能作氧化剂
B .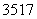 Cl、
Cl、 Cl为不同的核素,有不同的化学性质
Cl为不同的核素,有不同的化学性质
C.实验室制备Cl2可用排饱和食盐水集气法收集
D.1.12 L Cl2含有1.7 NA个质子(NA表示阿伏加德罗常数)
 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
下列关于原子结构、元素性质的说法正确的是( )
A.非金属元素组成的化合物中只含共价键
B.ⅠA族金属元素是同周期中金属性最强的元素
C.同种元素的原子均有相同的质子数和中子数
D.ⅦA族元素的阴离子还原性越强,其最高价氧化物对应水化物的酸性越强
查看答案和解析>>
科目:高中化学 来源: 题型:
下列五种烃:①2—甲基丁烷;②2,2—二甲基丙烷;③戊烷;④丙烷;⑤丁烷;
按它们的沸点由高到低的顺序排列正确的是
A.①>②>③>④>⑤ B.②>③>⑤>④>①
C.③>①>②>⑤>④ D.④>⑤>②>①>③
查看答案和解析>>
科目:高中化学 来源: 题型:
溴化碘(IBr)的化学性质与卤素单质相似,能与大多数金属反应生成金属卤化物,和某些非金属单质反应生成相应的卤化物,跟水反应的方程式为IBr+H2O===HBr+HIO,下列有关IBr的叙述中,不正确的是 ( )。
A.IBr是双原子分子
B.在很多反应中,IBr是强氧化剂
C.和NaOH溶液反应生成NaBr和NaIO
D.和水反应时,既是氧化剂又是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
氯气是氯碱工业的主要产品之一,是一种常用的消毒剂,其消毒原理是与水反应生成了次氯酸:
Cl2+H2OHCl+HClO
次氯酸的强氧化性能杀死水中的病菌(不直接用次氯酸为自来水消毒是因为次氯酸易分解,且毒性较大)。但是由于氯气贮运不方便,且具有一定的危险性,目前正逐渐被其他性能优越的消毒产品所替代。请回答:
(1)氯碱工业生产氯气的化学方程式为_________________________________ _____________________________________________。
(2)84消毒液与氯气相比具有贮运方便等优点,用氯气与烧碱溶液反应制备84消毒液的离子方程式为__________________________________________ _______________________________________________________________。
(3)二氧化氯(ClO2)是目前国际上公认的最新一代的高效、广谱、安全的杀菌、保鲜剂。我国科学家研发了用氯气氧化亚氯酸钠(NaClO2)固体制备二氧化氯的方法,其化学方程式为_________________________________________ _______________________________________________________________________________________________________。
(4)一位同学设计了一套用浓盐酸和KMnO4固体制取少量氯气并比较氯气与碘单质的氧化性强弱的微型装置(如图所示)。

①下列溶液能吸收Cl2的是____________________________。
A.饱和食盐水 B.饱和Na2SO3溶液
C.饱和NaOH溶液 D.浓硫酸
②能说明Cl2的氧化性强于I2的实验现象是____________________________ ____________________________________________________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学向一支试管中按一定的顺序分别加入下列几种物质(一种物质只加一次):
a.KI溶液;b.淀粉溶液;c.NaOH溶液;d.稀H2SO4;e.氯水。发现溶液颜色按如下顺序变化:①无色→②棕黄色→③蓝色→④无色→⑤蓝色,对此过程进行的分析中错误的是 ( )。
A.加入以上药品的顺序是a→e→b→c→d
B.③→④反应的化学方程式为I2+2NaOH===NaI+NaIO3+H2O
C.溶液由棕黄色变为蓝色的原因是淀粉溶液遇碘变蓝色
D.④→⑤反应的离子方程式为2I-+Cl2===I2+2Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
关于硅及其化合物的叙述中,错误的是 ( )。
A.硅是良好的半导体材料
B.二氧化硅能与石灰石反应:SiO2+CaCO3 CaSiO3+CO2↑
CaSiO3+CO2↑
C.可以用焦炭还原二氧化硅生产硅:SiO2+2C Si+2CO↑
Si+2CO↑
D.水泥的主要成分是Na2SiO3、CaSiO3和SiO2
查看答案和解析>>
科目:高中化学 来源: 题型:
下列图像能表示相关反应中生成物物质的量的变化的是(横、纵坐标单位:mol) ( )。
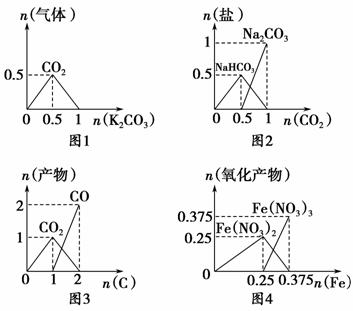
A.图1:n(HCl)=1 mol,K2CO3加入到HCl溶液中,在敞口容器中生成的气体
B.图2:n(NaOH)=1 mol,CO2通入到NaOH溶液中反应生成的盐
C.图3:n(O2)=1 mol,高温下C和O2在密闭容器中的生成物
D.图4:n(HNO3)=1 mol,Fe和稀HNO3反应生成的氧化产物(还原产物为NO)
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液中可能含有大量的Mg2+、Al3+、H+、Cl-和少量OH-,向该溶液中逐滴加入0.5 mol·L-1 NaOH溶液,生成沉淀的质量和加入NaOH溶液的体积之间的关系如下图所示,则可判断原溶液中 ( )。
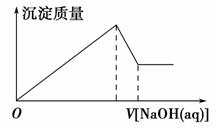
A.有Mg2+,没有Al3+ B.有Al3+,没有Mg2+
C.有Mg2+和Al3+ D.有大量的H+、Mg2+和Al3+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com