
已知下表数据:
|
物质 |
熔点/℃ |
沸点/℃ |
密度/(g/cm3) |
|
乙醇 |
-144 |
78 |
0.789 |
|
乙酸 |
16.6 |
117.9 |
1.05 |
|
乙酸乙酯 |
-83.6 |
77.5 |
0.90 |
|
浓硫酸 |
—— |
338 |
1.84 |
某学生做乙酸乙酯的制备实验
(1)写出该反应的化学反应式 。
(2)按装置图安装好仪器后,将在大试管中配制好体积比为3︰2的乙醇和乙酸混合溶液与浓硫酸混合时的操作要点是 。
(3)根据上表数据分析,为什么乙醇需要过量一些,其原因是 。
按正确操作重新实验,该学生很快在小试管中收集到了乙酸乙酯、乙酸、乙醇的混合物。现拟分离含乙酸、乙醇和水的乙酸乙酯粗产品,下图是分离操作步骤流程图。在图中圆括号表示加入适当的试剂,编号表示适当的分离方法。
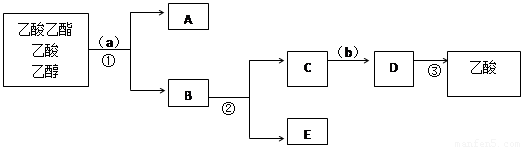
(4)写出加入的试剂: 试剂(a)是 ;试剂(b)是 。
(5)写出有关的操作分离方法:①是 ,②是 ,③是 。
(1)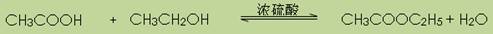
(2)将浓硫酸缓缓沿玻璃棒注入混合溶液中,并不断搅拌。(2分)
(3)乙醇的沸点比乙酸较低,易挥发而损耗(2分)
(4)饱和碳酸钠溶液 (1分); 稀硫酸(1分)
(5)分液,蒸馏,蒸馏(各2分,共6分)
(6)除去乙酸乙酯中混有的少量水(2分)
【解析】(1)乙醇和乙酸通过酯化反应生成乙酸乙酯,同时还有水生成。
(2)由于浓硫酸溶于水放热,且浓硫酸的密度大于水,所以正确的操作是将浓硫酸缓缓沿玻璃棒注入混合溶液中,并不断搅拌。
(3)根据物质的沸点可知,乙醇的沸点比乙酸较低,易挥发而损耗,所以乙醇要过量。
(4)乙酸乙酯不溶于水,而乙醇和乙酸与水是互溶的,所以可以利用饱和碳酸钠溶液除去杂质乙酸和乙醇,即a是饱和碳酸钠溶液。然后分液,即得到A和B,其中A是乙酸乙酯,B是乙酸钠、乙醇和碳酸钠的混合液。要得到乙醇,蒸馏即可,所以E是乙醇。C中含有乙酸钠和碳酸钠,要得到乙酸,则需要加入硫酸,生成乙酸,然后再通过蒸馏即可。


 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:
一定温度下的难溶电解质AmBn在水溶液中达到溶解平衡时.已知下表数据物质对含等物质的量的CuSO4、FeSO4、Fe2(SO4)3的混合溶液的说法,不科学的是( )
|
查看答案和解析>>
科目:高中化学 来源: 题型:
(2011?湛江模拟)一定温度下的难溶电解质AmBn在水溶液中达到溶解平衡时.已知下表数据
|
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下的难溶电解质AmBn在水溶液中达到溶解平衡时.已知下表数据
|
查看答案和解析>>
科目:高中化学 来源: 题型:
已知下表数据:
|
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下的难溶电解质AmBn在水溶液中达到沉淀溶解平衡时,其平衡常数Ksp=cm(An+)×cn(Bm-),称为难溶解电解质的溶度积.已知下表数据:
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com