
| A. | NaCl、Br2、I2 | B. | NaCl | C. | NaCl、Br2 | D. | NaCl、I2 |
分析 向含有NaBr、NaI的溶液中通入过量的Cl2,发生的反应为2NaBr+Cl2=2NaCl+Br2、2NaI+Cl2=I2+2NaCl,溴和碘都不稳定,碘受热易升华,溴易挥发,据此分析解答.
解答 解:向含有NaBr、NaI的溶液中通入过量的Cl2,发生的反应为2NaBr+Cl2=2NaCl+Br2、2NaI+Cl2=I2+2NaCl,溴和碘都不稳定,碘受热易升华,溴易挥发,NaCl属于离子化合物,熔点较高,所以灼烧后最终得到的固体是NaCl,故选B.
点评 本题考查非金属元素之间的置换反应,明确物质的氧化性、物质的物理性质即可解答,熟练掌握同一主族、同一周期元素性质递变规律,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
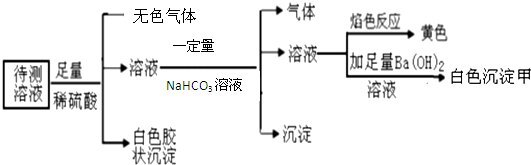
| A. | 一定含有Na+,可能存在K+ | |
| B. | 至少存在4种离子 | |
| C. | 无色气体是NO气体 | |
| D. | 白色沉淀甲中一定含有BaSO4和BaCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Na+)>c(CO32-)>c(HCO3-) | |
| B. | c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-) | |
| C. | c(Na+)>c(HCO3-)>c(H+)>c(OH-) | |
| D. | c(HCO3-)+2c(CO32-)+c(H2CO3)=1 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
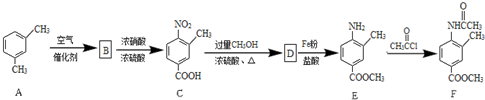
 .
. .
.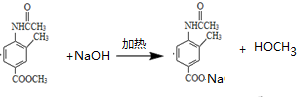 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | R一定是第2周期元素 | |
| B. | R一定是VA族元素 | |
| C. | R的气态氢化物一定比同周期其他元素气态氢化物稳定 | |
| D. | R气态氢化物化学式为H2R |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com