
| A. | 高温下二氧化硅与碳酸钠反应放出二氧化碳,说明硅酸(H2SiO3)的酸性比碳酸强 | |
| B. | 陶瓷、玻璃、水泥容器都能贮存氢氟酸 | |
| C. | 石灰抹墙、水泥砌墙的硬化过程原理不相同 | |
| D. | 硫酸钠溶液、烧碱溶液、硝酸溶液、浓硫酸四种溶液均能用带玻璃塞的试剂瓶保存 |
分析 A.根据反应条件分析,该反应条件不是常温下溶液中,所以不能据此判断酸性强弱;
B.根据陶瓷、玻璃、水泥容器的成分分析,二氧化硅能和HF反应;
C.石灰抹墙硬化是利用氢氧化钙和二氧化碳的反应,水泥砌墙是利用水泥的凝固性;
D.玻璃的成分中含有二氧化硅,二氧化硅是酸性氧化物,能和强碱反应,能和氢氟酸反应,带玻璃塞的试剂瓶不能存放呈强碱性的物质;
解答 解:A.高温条件下,虽然二氧化硅和碳酸钠反应生成二氧化碳,但该反应条件是高温而不是常温,所以不能据此判断酸性强弱,应根据溶液中进行的反应来判断,故A错误;
B.陶瓷、玻璃、水泥的主要成分都是硅酸盐,玻璃中含有二氧化硅,二氧化硅和HF反应生成SiF4,所以不能用玻璃容器盛放HF,故B错误;
C.石灰抹墙硬化发生的反应为Ca(OH)2+CO2=CaCO3↓+H2O,水泥砌墙是利用水泥的凝固性,所以原理不同,故C正确;
D.硫酸钠溶液,不和二氧化硅反应,所以可以带玻璃塞的试剂瓶盛放,硝酸呈酸性,不和二氧化硅反应,所以可以带玻璃塞的试剂瓶盛放,浓硫酸呈酸性,不和二氧化硅反应,所以可以带玻璃塞的试剂瓶盛放,氢氧化钠呈强碱性,能和二氧化硅反应生成硅酸钠,硅酸钠具有黏性,能把玻璃塞黏住,所以不可以带玻璃塞的试剂瓶盛放,故D错误;
故选C.
点评 本题考查了无机非金属材料硅及其化合物的性质,陶瓷、玻璃、水泥容器和强酸不反应,但能和氢氟酸反应,所以不能用陶瓷、玻璃、水泥容器贮存氢氟酸,注意D化学试剂的存放,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 用氯气和消石灰制漂白粉 | B. | 铝热法冶炼金属钒 | ||
| C. | 用石灰石、纯碱、二氧化硅制玻璃 | D. | 电解饱和食盐水制烧碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 呈酸性 | B. | 呈中性 | C. | 呈碱性 | D. | 无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
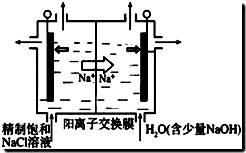
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
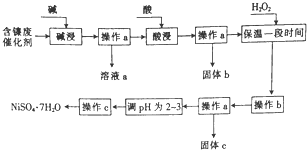 某化学小组通过查阅资料,设计了如图所示的方法以含镍废催化剂为原料来制备NiSO4•7H2O,已知某化工厂的含镍废催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%).
某化学小组通过查阅资料,设计了如图所示的方法以含镍废催化剂为原料来制备NiSO4•7H2O,已知某化工厂的含镍废催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%).| 沉淀物 | 开始沉淀时的pH | 完全沉淀时的pH |
| Al(OH)3 | 3.8 | 5.2 |
| Fe(OH)3 | 2.7 | 3.2 |
| FE(OH)2 | 7.6 | 9.7 |
| Ni(OH)2 | 7.1 | 9.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸是铅蓄电池的电解质溶液,铅蓄电池可实现化学能转变成电能 | |
| B. | 硅酸干凝胶是硅酸干燥剂的主要成分,作用是吸收水分 | |
| C. | 肥皂的主要成分是硬脂酸钠,可以用于除去油污 | |
| D. | 二氧化硅是光能转化为电能的转化材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 金属 | 颜色 | 密度(g/cm3) | 熔点(℃) | 沸点(℃) | 比热[KJ/kg•℃] |
| Fe | 银白色 | 7.86 | 1 535 | 2 750 | 0.44 |
| Cu | 红色 | 8.92 | 1 083 | 2 567 | 0.38 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
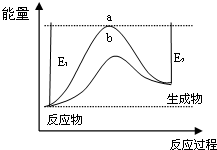
| 浓度/mol•L-1 时间 | c(NH3) | c(O2) | c(NO) |
| 0min | 1.000 | 1.600 | 0.000 |
| 2min | 0.600 | a | 0.400 |
| 4min | 0.500 | 0.975 | 0.500 |
| 6min | 0.500 | 0.975 | 0.500 |
| 8min | 0.700 | 1.225 | 0.750 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com