
【题目】下列说法正确的是
A.除去乙醇中微量水用金属钠
B.溴苯中混有溴,加入水萃取
C.用酸性高锰酸钾除去乙烷中的乙烯
D.除去乙醇中少量的乙酸:加足量生石灰,蒸馏。
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
【实验原理】2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O
【实验内容及记录】
实验编号 | 实验温度 | 试管中所加试剂及其用量/mL | 溶液褪至无色所需时间/min | |||
0.6mol/L H2C2O4溶液 | H2O | 3mol/L 稀H2SO4溶液 | 0.05mol/L KMnO4溶液 | |||
① | 25 | 3.0 | V1 | 2.0 | 3.0 | 1.5 |
② | 25 | 2.0 | 3.0 | 2.0 | 3.0 | 2.7 |
③ | 50 | 2.0 | V2 | 2.0 | 3.0 | 1.0 |
(1)请完成此实验设计,其中:V1= ,V2= 。
(2)实验①、②探究的是 对化学反应速率的影响,根据上表中的实验数据,可以得到的结论是_________________________________________________________。
(3)探究温度对化学反应速率的影响,应选择________________(填实验编号)。
(4)利用实验1中的数据,计算用KMnO4表示的化学反应速率为____________________。
(5)该小组同学根据经验绘制了n(Mn2+)随时间变化的趋势如图1所示,但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的实际趋势如图2所示。

该小组同学根据图2所示信息提出了新的假设,并设计以下实验方案继续进行实验探究。
实验编号 | 实验温度/℃ | 试管中所加试剂及其用量 | 再向试管中加入某种固体 | 溶液褪至无色所需时间/min | |||
0.6mol/L H2C2O4溶液 | H2O | 3mol/L 稀H2SO4溶液 | 0.05mol/L KMnO4溶液 | ||||
④ | 25 | 2.0 | 3.0 | 2.0 | 3.0 | MnSO4 | t |
①该小组同学提出的假设是________________________________________________。
②若该小组同学提出的假设成立,应观察到________________________________现象。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质分类的说法正确的是( )
A.稀豆浆、烟水晶、氯化铁溶液都属于胶体
B.Na2O、MgO、Mn2O7均属于碱性氧化物
C.氨水、冰醋酸、溴乙烷都属于弱电解质
D.葡萄糖、油脂、氨基酸都不属于有机高分子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国清代《本草纲目拾遗》中记叙无机药物335种,其中“强水”条目下写道:“性最烈,能蚀五金……其水甚强,五金八石皆能穿第,惟玻璃可盛。”这里的“强水”是指
A.氨水
B.硝酸
C.醋
D.卤水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷单质及其化合物在工业生产巾有着广泛的应用。向磷可用于制备高纯度的磷酸(磷酸结构简式为 ),三聚磷酸钠是常用的水处理剂,次磷酸钠(Nail2P@)可用于化学镀镍等等。完成下列填空:
),三聚磷酸钠是常用的水处理剂,次磷酸钠(Nail2P@)可用于化学镀镍等等。完成下列填空:
(1)磷元素原子核外最外层电子排布式为 。NaH2PO2中涉及到四种元素,它们的原子半径由小到大的顺序为 (填元素符号)。
(2)氧原子核外有 种不同能量的电子。
(3)海产品添加剂多聚磷酸钠是由Na+与多聚磷酸根离子组成的,某种多聚磷酸根的结构如图。

①磷原子的杂化类型为 ;②这种多聚磷酸钠的化学式为
(4) 次磷酸(H3PO2)是一种精细磷化工产品,具有较强还原性
①NaH2PO2为 (填“正盐”或“酸式盐”),其溶液显 (填“弱酸性”“中性”或“弱碱性”)
②次磷酸钠(NaH2PO2)可用于化学镀镍.化学镀镍的溶液中含有Ni2+和H2PO2-,在一定条件下能发生如下反应生成Ni和H2PO3-,写出上述反应离子方程式
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为氧化铝,含少量氧化铁)制取铝的过程如图所示:
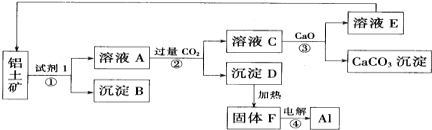
(1)试剂1为______(填化学式),①~④转化过程中_____消耗能量最多。
(2)沉淀B的化学式为______。
(3)电解F,当转移6mol电子时,可制得铝______ g。
(4)生产过程中,除物质E可以循环使用外,还可以循环使用的物质有______(填化学式)。
(5)写出离子方程式:①______, ② ______。
(6)写出化学方程式:④______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.工业上可用CO或CO2来生产燃料甲醇。已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
化学反应 | 平衡 常数 | 温度/℃[ | |
500 | 800 | ||
①2H2(g)+CO(g) | K1 | 2.5 | 0.15 |
②H2(g)+CO2(g) | K2 | 1.0 | 2.50 |
③3H2(g)+CO2(g) | K3 | ||
(1)据反应①与②可推导出K1、K2与K3之间的关系,则K3=________(用K1、K2表示)。500 ℃时测得反应③在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol·L-1)分别为0.8、0.1、0.3、0.15,则此时v正________v逆(填“>”、“=”或“<”)。
(2)在3 L容积可变的密闭容器中发生反应②,已知c(CO)—反应时间t变化曲线Ⅰ如图所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ。当曲线Ⅰ变为曲线Ⅱ时,改变的条件是_______________。当曲线Ⅰ变为曲线Ⅲ时,改变的条件是______________。

Ⅱ.利用CO和H2可以合成甲醇,反应原理为CO(g)+2H2(g) ![]() CH3OH(g)。一定条件下,在容积为V L的密闭容器中充入a mol CO与2a mol H2合成甲醇,平衡转化率与温度、压强的关系如下图所示。
CH3OH(g)。一定条件下,在容积为V L的密闭容器中充入a mol CO与2a mol H2合成甲醇,平衡转化率与温度、压强的关系如下图所示。 
(1)p1________p2(填“>”、“<”或“=”),理由是 。
(2)该甲醇合成反应在A点的平衡常数K= (用a和V表示)。
(3)该反应达到平衡时,反应物转化率的关系是CO________H2。(填“>”、“<”或“=”)
(4)下列措施中能够同时满足增大反应速率和提高CO转化率的是________(填字母)。
A.使用高效催化剂 B.降低反应温度
C.增大体系压强 D.不断将CH3OH从反应混合物中分离出来
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物由C、H、O三种元素组成,分子中含有8个原子,1mol该有机物含有46mol质子.完全燃烧该有机物在相同条件下测定CO2和水蒸气体积比为2:1。取2.7g该有机物恰好与30mL 1mol/L的碳酸钠溶液完全反应。(请写出必要的计算过程)求:
(1)有机物分子式;
(2)有机物结构简式.
(3)写出该有机物在一定条件下与乙二醇反应生成六元环状化合物的方程式。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学--选修5:有机化学基础]氰基丙烯酸酯在碱性条件下能快速聚合为![]() ,从而具有胶黏性,某种氰基丙烯酸酯(G)的合成路线如下:
,从而具有胶黏性,某种氰基丙烯酸酯(G)的合成路线如下:
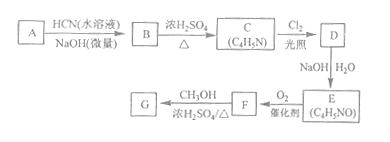
已知:①A的相对分子量为58,氧元素质量分数为0.276,核磁共振氢谱显示为单峰
②
回答下列问题:
(1)A的化学名称为_______。
(2)B的结构简式为______,其核磁共振氢谱显示为______组峰,峰面积比为______。
(3)由C生成D的反应类型为________。
(4)由D生成E的化学方程式为___________。
(5)G中的官能团有___、 ____ 、_____。(填官能团名称)
(6)G的同分异构体中,与G具有相同官能团且能发生银镜反应的共有_____种。(不含立体异构)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com