
�����������������ȵ������ҵ��µĴ�л�����ۺ�֢���Ը�Ѫ��Ϊ��Ҫ��־���������������ʳƷ��ȱ���˶������»�����
(1)Ѫ����ָѪҺ�е������ǣ�����˵����ȷ����________(�����)��
A������������̼ˮ���������ʽ�ɱ�ʾΪC6(H2O)6����ÿ�������Ƿ����к�6��H2O����
B���������Ƶ�������ͭ����Һ�������������Һ�е������Ǻ���
C�������ǿ������ƾ���ҵ
D�����ۡ���ά��ˮ������ղ��ﶼ��������
(2)ľ�Ǵ���һ����ζ����������ʳ�ú�ʹѪ�����ߡ�ľ�Ǵ���������________(���Ϊ������Ϊ��)ͬ���칹�塣��Ԥ��ľ�Ǵ���һ�ֻ�ѧ���ʣ�________��
(3)�����˲������ƣ��ƾ��ڸ����ڿɱ�ת�����л���A����֪A����Է�������Ϊ60����A����ˮ������ʯ����Һ��������Һ��졣��A�Ľṹ��ʽΪ_____________________________________________ ___________________________��
������(1)�������Ǵ���������Ƿ����в���H2O��A������������������������ͭ��Ӧ������ש��ɫ������B��ȷ����֪C��D����ȷ��(2)ľ�Ǵ��ķ���ʽΪC5H12O5���������ǵķ���ʽ��ͬ�����߲���ͬ���칹�壻ľ�Ǵ������к����ǻ��������������ƣ��ɷ���������Ӧ����������Ʒ�Ӧ����ȼ�գ�����ͭ�����Ĵ������·���������Ӧ��(3)������Ϣ��֪A�����ԣ������ᡣ
�𰸡�(1)BCD
(2)����Ϊ���������ᷢ��������Ӧ(��������Ʒ�Ӧ������������ȼ�ա���������������������������)
(3)CH3COOH


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�������������벻��ˮ
��1����Ȼ���е�ˮ�����Ǵ��������ˮ�����ó����������� �������ȷ�������ˮ��
��2����Ӿ�س��ö������ȣ�ClO2�������������û���������Ԫ�ػ��ϼ��� ����
��3��д�����ˮ��Ӧ�����ֱ���ʽ����ű���ʽ�� ______ ���÷�Ӧ���ڣ��������Ӧ���ͣ� ��Ӧ��
��4�������˿��������ȼ��ʵ��ʱ�����ڼ���ƿ��װ����ˮ����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ҵ����H2��N2ֱ�Ӻϳɰ���N2��3H22NH3�����д�ʩ�϶���ʹ�ϳɰ���Ӧ���ʼӿ����(����)
�������¶ȡ��ڼ�����������������Ӧ��Ũ��
������ѹǿ
A��ֻ�Т٢ڢ� B��ֻ�Т٢ڢ�
C��ֻ�Т٢ۢ� D���٢ڢۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��һ���¶ȡ�ѹǿ�ʹ��������£���N2��H2��13(�����)��ϣ�����Ӧ�ﵽƽ��ʱ�����������NH3ռ25%(�����)����
(1)N2��ת����__________________��
(2)��Ӧǰ�����֮��__________________��
(3)ƽ��������ƽ����Է�������__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���������У�������ѧ��Ӧ����ʹ��ˮ��ɫ������ʹ���Ը��������Һ��ɫ����(����)
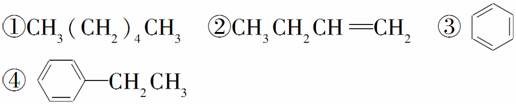
A���� B���ۢ�
C���٢� D���ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
H2��O2������Ӧ�Ĺ�����ģ��ͼʾ���£���������ʾ��ѧ����������˵������ȷ���ǣ�������
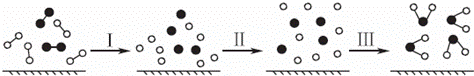
| �� | A�� | ���̢������ȹ��� |
| �� | B�� | ���̢�һ���Ƿ��ȹ��� |
| �� | C�� | �÷�Ӧ�������оɻ�ѧ�������ѣ����γ����»�ѧ�� |
| �� | D�� | �÷�Ӧ������ת����ʽֻ�������ܵ���ʽ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
25��ʱ���ں���Pb2+��Sn2+��ij��Һ�У����������������Sn����������Ӧ��Sn��s��+Pb2+��aq��⇌Sn2+��aq��+Pb��s������ϵ��c��Pb2+����c��Sn2+���仯��ϵ��ͼ��ʾ�������ж���ȷ���ǣ�������
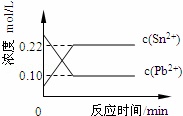 |
| �� | A�� | ��ƽ����ϵ�м������Ǧ��c��Pb2+������ |
| �� | B�� | ��ƽ����ϵ�м�������Sn��NO3��2�����c��Pb2+����С |
| �� | C�� | �����¶ȣ�ƽ����ϵ��c��Pb2+������˵���÷�Ӧ��H��0 |
| �� | D�� | 25��ʱ���÷�Ӧ��ƽ�ⳣ��K=2.2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
1)��֪Na2S2O3 + H2SO4 = Na2SO4 + S��+ SO2 + H2O ����ͬѧͨ���ⶨ�÷�Ӧ����ʱ��Һ����ǵ�ʱ�䣬�о���������Ի�ѧ��Ӧ���ʵ�Ӱ�졣���ʵ�����£���ȡ��Һ�����Ϊ10mL����
| ʵ���� | ʵ���¶�/�� | c(Na2S2O3)/mol��L-1 | c(H2SO4)/mol��L-1 |
| �� | 25 | 0.1 | 0.1 |
| �� | 25 | 0.1 | 0.2 |
| �� | 50 | 0.2 | 0.1 |
| �� | 50 | 0.1 | 0.1 |
������������ʱ��̽��Ũ�ȶԻ�ѧ��Ӧ���ʵ�Ӱ�죬Ӧѡ��____________������ʵ���ţ���
̽���¶ȶԻ�ѧ��Ӧ���ʵ�Ӱ�죬Ӧѡ��____________������ʵ���ţ���
(2)��ͬѧ�������ʵ������̽��Na2S2O3�Ļ�ѧ���ʡ�
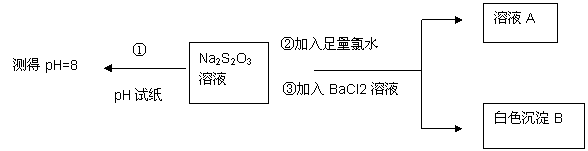
����ͬѧ���ʵ�����̵�Ŀ����֤��Na2S2O3��Һ���м��Ժ�____________ �ԡ�
�������ɰ�ɫ����B�����ӷ���ʽ�� ____________��
������֪Na2S2O3��Һ��Cl2��Ӧʱ�� 1mol Na2S2O3ת��8 mol���ӡ��÷�Ӧ�����ӷ���ʽ��____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ʵ����������ʯ������Ҫ��CaO��CaC2������C��SiO2��Ϊԭ���Ʊ�����ص�ʵ�����̼�������ʵ��ܽ�����£�
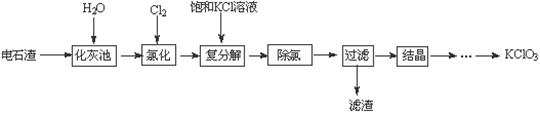
| ���������ܽ�����¶ȵĹ�ϵ | |||||
| �¶� | 0 | 10 | 20 | 30 | 40 |
| S(CaCl2)/g | 59.5 | 64.7 | 74.5 | 100 | 128 |
| S[Ca(ClO3)2]/g | 209 | ||||
| S(KClO3)/g | 3.3 | 5.2 | 7.3 | 10.2 | 13.9 |
��1�� ���ҳ���CaC2��ˮ��Ӧ�Ļ�ѧ����ʽΪ ��
��2����80���Ȼ�ʱ��������Ƽ��Ȼ��ƵĻ�ѧ����ʽΪ ����ȥ��Һ�ж���������ļ����� ��
��3������KCl��Һ��������Ʒ�Ӧ��ԭ���� ��
��4�������еijɷ���Ҫ�� ��д��ѧʽ�����ӹ��˺����Һ�л��KClO3����ķ����� �� ��ϴ�ӡ���ɡ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com