
| A. | 5种 | B. | 6种 | C. | 8种 | D. | 10种 |
分析 仅含碳、氢、氧三种元素的某化合物,其相对分子质量为88,且氧的质量分数为18.18%,分子中N(O)=$\frac{88×18.18%}{16}$=1,去掉1个O原子后剩余基团总式量为88-16=72,则最大碳原子数目=$\frac{72}{12}$=6,则该有机物含有5个C原子、12H原子,分子式为C5H12O,该化合物不与钠反应,不含醇羟基,属于醚,再根据烃基异构进行分析解答.
解答 解:仅含碳、氢、氧三种元素的某化合物,其相对分子质量为88,且氧的质量分数为18.18%,分子中N(O)=$\frac{88×18.18%}{16}$=1,去掉1个O原子后剩余基团总式量为88-16=72,则最大碳原子数目=$\frac{72}{12}$=6,则该有机物含有5个C原子、12H原子,分子式为C5H12O,该化合物不与钠反应,不含醇羟基,属于醚,
当一个烃基为-CH3、另外烃基为-CH2CH2CH2CH3,-CH(CH3)CH2CH3,-C(CH3)3,-CH2CH(CH3)2,
当一个烃基为-CH2CH3,另外烃基为-CH2CH2CH3,-CH(CH3)2,
故符合条件的同分异构体共有6种,
故选B.
点评 本题考查有机物推断、同分异构体书写,侧重考查学生分析计算能力,注意利用残余法、商余法确定有机物分子式,同分异构体判断中可以利用形成醚的醇分析,难度中等.


 53天天练系列答案
53天天练系列答案科目:高中化学 来源: 题型:解答题
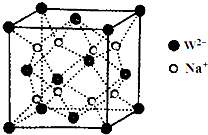 前四周期元素X、Y、Z、W、R、Q的原子序数依次增大,X的核外电子总数与其周期数相同;Y有三个能级,且每个能级上的电子数相等;Z原子单电子数在同周期元素中最多;W与Z同周期,第一电离能比Z的低;R与Y同一主族,Q的最外层电子数为2,其他电子层电子均处于饱和状态.请回答下列问题:
前四周期元素X、Y、Z、W、R、Q的原子序数依次增大,X的核外电子总数与其周期数相同;Y有三个能级,且每个能级上的电子数相等;Z原子单电子数在同周期元素中最多;W与Z同周期,第一电离能比Z的低;R与Y同一主族,Q的最外层电子数为2,其他电子层电子均处于饱和状态.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 熔点:Li>Na>K | B. | 还原性:HCl<H2S<PH3 | ||
| C. | 酸性强弱:H2SiO3<H2CO3<H2SO4 | D. | 原子半径:Na<Mg<Al |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32- | |
| B. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- | |
| C. | 加入KSCN溶液,若溶液变成血红色,则一定有Fe3+ | |
| D. | 加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,pH=13的 Ba(OH)2溶液中含有的OH-数目为0.2 NA | |
| B. | 2.24LCO和CO2的混合气体中所含的碳原子数一定是NA | |
| C. | 78g苯含有C=C双键的数目为3NA | |
| D. | 5.6 g铁和6.4 g铜分别与0.1 mol氯气完全反应,转移的电子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| C6H5Cl(氯苯) | C6H4Cl2 | FeCl3 | FeCl2 | |
| 溶解性 | 不溶于水,易溶于苯 | 不溶于C6H5Cl、C6H4Cl2、苯,易吸水. | ||
| 熔点/℃ | -45 | 53 | -- | -- |
| 沸点/℃ | 132 | 173 | -- | -- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为了防止中秋月饼的富脂食物因被氧化而变质,常在包装袋里放还原铁粉 | |
| B. | 天然植物油常温下一般呈液态,难溶于水,有固定的熔点、沸点 | |
| C. | 麦芽糖与蔗糖的水解产物均含葡萄糖,故二者均为还原型二糖 | |
| D. | 若两种二肽互为同分异构体,则二者的水解产物一定不相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
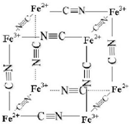 铁及其化合物在生产生活及科学研究方面应用非常广泛.
铁及其化合物在生产生活及科学研究方面应用非常广泛. ,其空间构型为直线型.
,其空间构型为直线型.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用铜电极电解硝酸银溶液:4Ag++2H2O$\frac{\underline{\;通电\;}}{\;}$4Ag+O2↑+4H+ | |
| B. | FeS中加入足量稀硝酸:FeS+2 H+=Fe2++H2↑ | |
| C. | 石灰石溶于醋酸溶液中:CaCO3+2H+=Ca2++H2O+CO2↑ | |
| D. | 澄清石灰水中通入过量的CO2:CO2+OH-=HCO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com