
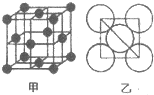
分析 铝原子半径为d,对角线上三个铝原子相邻,对角线长度=4d,则晶胞棱长=$\sqrt{\frac{(4d)^{2}}{2}}$=2$\sqrt{2}$d,晶胞体积=(2$\sqrt{2}$d)3,该晶胞中Al原子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,晶胞密度=$\frac{m}{V}$;
每个铝原子体积=$\frac{4}{3}π{d}^{3}$,该晶胞中含有4个Al原子,所以晶胞中所有铝原子体积=4×$\frac{4}{3}π{d}^{3}$,空间利用率=$\frac{所有铝原子体积}{晶胞体积}×100%$.
解答 解:铝原子半径为d,对角线上三个铝原子相邻,对角线长度=4d,则晶胞棱长=$\sqrt{\frac{(4d)^{2}}{2}}$=2$\sqrt{2}$d,晶胞体积=(2$\sqrt{2}$d)3,该晶胞中Al原子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,晶胞密度=$\frac{m}{V}$=$\frac{\frac{M}{{N}_{A}}×4}{(2\sqrt{2}d)^{3}}$g/cm3=$\frac{\sqrt{2}M}{8{N}_{A}{d}^{3}}$g/cm3;
每个铝原子体积=$\frac{4}{3}π{d}^{3}$,该晶胞中含有4个Al原子,所以晶胞中所有铝原子体积=4×$\frac{4}{3}π{d}^{3}$,空间利用率=$\frac{所有铝原子体积}{晶胞体积}×100%$=$\frac{4×\frac{4}{3}π{d}^{3}}{(2\sqrt{2}d)^{3}}$×100%=74%,
故答案为$\frac{\sqrt{2}M}{8{N}_{A}{d}^{3}}$g/cm3;74%.
点评 本题考查晶胞计算,侧重考查分析计算能力及空间想象能力,明确密度公式中“$\frac{M}{{N}_{A}}×4$”的含义是解本题关键,注意棱上两个原子不相邻,为易错点.


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:选择题
| A. | 在研究物质微观结构的过程中,科学家先后使用了扫描隧道显微镜、光学显微镜、电子显微镜等观测仪器 | |
| B. | “纳米铜”具有非常强的化学活性,在空气中可以燃烧,因为它比铜片更易失去电子 | |
| C. | 室温离子液体是指在室温或接近室温下呈现的完全由阴、阳离子所组成的盐,(C2H5NH3)NO3可能是其中一种 | |
| D. | 肼、氨、甲醇燃料电池的热值远高于燃料普通燃烧的热值 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
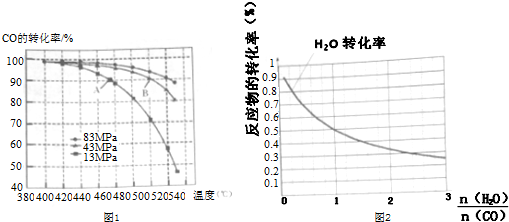
| 共价键 | H-H | C-H | C-O | O-H |
| 键能(kJ-mol-3) | 436 | 414 | 326 | 464 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (CH3)2C(Cl)CH2CH3的名称为:2-氯-2-甲基丁烷 | |
| B. | 某烷烃主链含4个碳原子的结构有2种,则与其碳原子个数相同且主链有4个碳原子的单烯烃有4种 | |
| C. | 1mol 与NaOH溶液反应,最多消耗5molNaOH 与NaOH溶液反应,最多消耗5molNaOH | |
| D. | 1molβ-紫罗兰酮(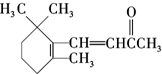 )与1molBr2发生加成反应得到3种不同产物 )与1molBr2发生加成反应得到3种不同产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5mol的Ba2+ | B. | 0.5mol的H+ | C. | 1.0mol的H+ | D. | 2.0mol的OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
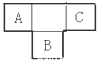 A、B、C为短周期元素,在周期表中所处的位置如图所示,A、C两元素的原子核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等
A、B、C为短周期元素,在周期表中所处的位置如图所示,A、C两元素的原子核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等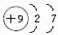 ,用电子式表示C的单质与H2反应的过程:
,用电子式表示C的单质与H2反应的过程: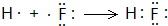 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H4、C6H6 | B. | CH4、CH2O | C. | C3H8、CH3CH2OH | D. | C2H6、CH3CHO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧分子的大小发生改变 | B. | 氧分子的质量发生改变 | ||
| C. | 氧分子变成了氧原子 | D. | 氧分子之间的间隔变小了 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com