
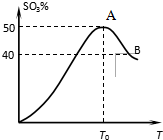
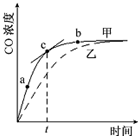
 在体积为2L密闭 绝热容器中,将物质的量均为2.00mol的SO2、O2混合,发生如下反应:2SO2(g)+O2(g)?2SO3(g),容器中SO3的体积分数
在体积为2L密闭 绝热容器中,将物质的量均为2.00mol的SO2、O2混合,发生如下反应:2SO2(g)+O2(g)?2SO3(g),容器中SO3的体积分数 分析 由图象可知温度T<T0时,反应未达到平衡,向正向移动,SO3%逐渐增大,温度大于T0时,温度升高,SO3%逐渐减小,说明平衡逆向移动,则正反应为放热反应,温度升高,反应速率增大,结合三段式计算达平衡时各物质的浓度,并以此计算转化率.
解答 解:(1)温度大于T0时,温度升高,SO3%逐渐减小,说明平衡逆向移动,则正反应为放热反应,故答案为:放热;
(2)温度升高,反应速率增大,则vA<vB,故答案为:<;
(3)设参加反应的氧气为xmol
2SO2(g)+O2(g)?2SO3(g)
起始的量:2mol 2mol 0
转化的量:2x x 2x
平衡的量:2-2x 2-x 2x
SO3的物质的量分数为50%,所以$\frac{2x}{2-2x+(2-x)+2x}$×100%=50%,所以x=0.8mol,则v(O2)=$\frac{\frac{n}{\;\;\;\;V\;\;\;\;}}{t}$=$\frac{\frac{0.8mol}{2L}}{10s}$=0.04 mol/(L•s),
故答案为:0.04 mol/(L•s);
(4)由图象可知温度T<T0时,反应未达到平衡,向正向移动,反应物二氧化硫和氧气会逐渐减少,三氧化硫就会逐渐增多,SO3%逐渐增大,
故答案为:由图象可知,当温度T<T0时反应还没有达到平衡状态,反应还在正向进行,反应物二氧化硫和氧气会逐渐减少,三氧化硫就会逐渐增多;
(5)设参加反应的氧气为xmol
2SO2(g)+O2(g)?2SO3(g)
起始的量:2mol 2mol 0
转化的量:2x x 2x
平衡的量:2-2x 2-x 2x
SO3的物质的量分数为40%,所以$\frac{2x}{2-2x+(2-x)+2x}$×100%=40%,所以x=$\frac{2}{3}$mol,所以n(SO2)=2x=$\frac{4}{3}$mol,所以SO2的转化率为$\frac{\;\;\frac{4}{3}\;\;\;}{2}$×100%=66.7%,
故答案为:66.7%.
点评 本题综合考查化学平衡的计算,为高考常见题型和高频考点,侧重于学生的分析能力和计算能力的考查,题目涉及反应速率的计算,转化率的计算,难度一般,根据有关公式即可求算.


科目:高中化学 来源:2017届吉林省高三上第二次模拟化学试卷(解析版) 题型:选择题
向100 mL 0.1 mol·L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1 mol·L-1 Ba(OH)2溶液。随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示。则下列说法中正确的是
A.a点的溶液呈中性
B.从开始到b点发生反应的总的离子方程式是:
Al3++2SO42-+2Ba2++3OH-= Al(OH)3↓+2BaSO4↓
C.c点加入Ba(OH)2溶液的体积为200 mL
D.c点溶液呈碱性
查看答案和解析>>
科目:高中化学 来源:2016-2017学年云南省高一9月月考化学卷(解析版) 题型:填空题
有一瓶溶液只含Cl-、CO 、SO
、SO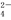 、Na+、Mg2+、Cu2+六种离子中的某几种.通过实验:
、Na+、Mg2+、Cu2+六种离子中的某几种.通过实验:
①原溶液 白色沉淀;
白色沉淀;
②原溶液中加BaCl2溶液不产生沉淀;
③原溶液中加AgNO3溶液产生白色沉淀,再加稀硝酸白色沉淀不溶解,回答下列问题:
(1)试分析原溶液中一定含有的离子是________,一定不含有的离子是________,可能含有的离子是________。
(2)有的同学认为实验③可以省略,你认为是否正确(填“是”或“否”)________,理由是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图为实验室制取少量乙酸乙酯的装置图.下列关于该实验的叙述中,不正确的是( )
如图为实验室制取少量乙酸乙酯的装置图.下列关于该实验的叙述中,不正确的是( )| A. | 向a试管中先加入浓硫酸,然后边摇动试管边慢慢加入乙醇,再加冰醋酸 | |
| B. | 试管b中导气管下端管口不能浸入液面的原因是防止实验过程中发生倒吸现象 | |
| C. | 实验时加热试管a的目的是及时将乙酸乙酯蒸出并加快反应速率 | |
| D. | 采用长玻璃导管有导气兼冷凝的作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
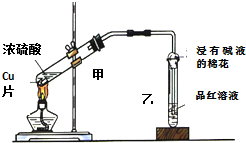 用如图装置做浓硫酸和铜反应的实验,实验过程中观察到甲试管底部有一些白色固体,乙试管中品红溶液褪色.
用如图装置做浓硫酸和铜反应的实验,实验过程中观察到甲试管底部有一些白色固体,乙试管中品红溶液褪色.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氮化铝(AlN)是一种人工合成的非氧化物陶瓷材料,可在温度高于1500℃时,通过碳热还原法制得.实验研究认为,该碳热还原反应分两步进行:
氮化铝(AlN)是一种人工合成的非氧化物陶瓷材料,可在温度高于1500℃时,通过碳热还原法制得.实验研究认为,该碳热还原反应分两步进行:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| t/s | 0 | t1 | t2 | t3 | t4 |
| n(SO3)/mol | 0 | 0.8 | 1.4 | 1.6 | 1.6 |
| A. | 反应在0~t1s内的平均速率v(SO2)=$\frac{0.8}{{t}_{1}}$mol•L-1•s-1 | |
| B. | 保持其他条件不变,若增大O2的浓度,到达新平衡时SO2转化率会增大 | |
| C. | 平衡时,再向容器中充入0.4mol SO2和1.6mol SO3,平衡不移动 | |
| D. | 保持温度不变,向该容器中再充入2 mol SO2、1mol O2,反应到达新平衡时$\frac{n(S{O}_{3})}{n({O}_{2})}$减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在任何条件下,化学平衡常数都是一个定值 | |
| B. | 化学平衡常数K可以推断一个可逆反应进行的程度 | |
| C. | 化学平衡常数K只与温度、反应物浓度、体系的压强有关 | |
| D. | 当改变反应物的浓度时,化学平衡常数会发生改变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com