含氮化合物对人类生活有十分重大的意义.
(1)目前广泛使用的工业合成氨方法是用氮气和氢气在一定条件下化合.
已知:N
2(g)+O
2(g)=2NO(g)△H=+180.5kJ/mol
4NH
3(g)+5O
2(g)=4NO(g)+6H
2O(g)△H=-905kJ/mol
2H
2(g)+O
2(g)=2H
2O(g)△H=-483.6kJ/mol
①写出工业合成氨的热化学方程式:
.
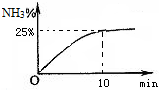
②实验室模拟合成氨,在2L密闭容器中投入1molN
2和3molH
2,容器中氨气的体积分数随时间变化如图所示.则0~10min,NH
3的平均速率为
;达平衡时,N
2的转化率为
.
③若在②达平衡后,保持容器体积及温度不变,移走0.5molNH
3,再达平衡时,N
2的体积分数将,平衡常数
(填“增大”“减小”或“不变”)
(2)科学家一直致力于研究常温常压下“人工固氮”的方法.据报道:在常温常压条件下,N2在催化剂(掺有少量Fe
2O
3的TiO
2)表面与水反应,生成NH3和一种单质.进一步研究NH3生成量与温度关系,部分实验数据如下(反应时间3h,其余条件一样)
| T/℃ | 30 | 40 | 50 |
| NH3生成量/10-6mol | 4.8 | 5.9 | 6.0 |
①写出常温下“人工固氮”反应的化学方程式:
此反应△H
0(填“>”、“<”或“=)
②该反应中的催化剂TiO
2的制取方法之一是将TiCl
4气体导入氢氧火焰中(700~1000℃)进行水解.写出TiCl
4水解的化学方程式:
.
③在上述固氮过程中,除加入催化剂外,能提高生产速率,但不降低产率的措施还可以是
.
A.适当升高温度
B.将氨气液化分离
C.增大反应物N
2的浓度
D.增大压强.

 含氮化合物对人类生活有十分重大的意义.
含氮化合物对人类生活有十分重大的意义.

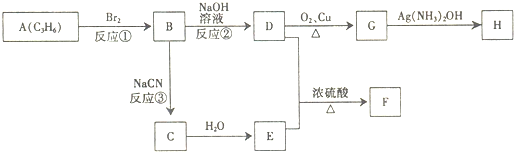

 有A、B、C、D、E、F六种短周期元素,其元素特征信息如表:
有A、B、C、D、E、F六种短周期元素,其元素特征信息如表: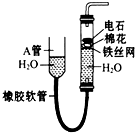 如图中的实验装置可用于制取乙炔.请填空:
如图中的实验装置可用于制取乙炔.请填空: