
分析 (1)乙烯含有碳碳双键;
(2)乙烯与溴水发生加成反应生成1,2-二溴乙烷;
乙烯燃烧生成二氧化碳和水;
(3)乙烯在负极失去电子,氧气在正极得到电子;
(4)燃料电池的电极材料可相同,能源利用率高;
(5)发生C4H10→C2H4+C2H6、C4H10→CH4+C3H6,结合反应计算.
解答 解:(1)乙烯官能团的名称是碳碳双键,故答案为:碳碳双键;
(2)乙烯与溴水发生加成反应生成1,2-二溴乙烷,该反应为CH2=CH2+Br2→CH2BrCH2Br,发生氧化反应为CH2=CH2+3O2$\stackrel{点燃}{→}$2CO2+2H2O,
故答案为:CH2=CH2+Br2→CH2BrCH2Br;CH2=CH2+3O2$\stackrel{点燃}{→}$2CO2+2H2O;
(3)在碱性溶液中,负极上为乙烯,失电子发生氧化反应,则负极反应为CH2=CH2-12e-+16OH-═2CO32-+10H2O,正极上为氧气,发生得电子的还原反应,正极反应为O2+2H2O+4e-=4OH-,故答案为:O2+2H2O+4e-=4OH-;CH2=CH2-12e-+16OH-═2CO32-+10H2O;
(4)A.形成原电池后,燃料从外部补充,能量利用率更高,为环保高效电池,故A正确;
B.电池正极、负极均没有火焰,故B错误;
C.电池工作时,消耗KOH,电解液pH减小,故C错误;
D.两极电极材料可以相同,如均为石墨或Pt电极,故D正确;
故答案为:AD;
(5)1mol丁烷,加热裂解,一段时间后,测得混合气体中含丁烷0.4mol,则0.6mol丁烷分解,由C4H10→C2H4+C2H6、C4H10→CH4+C3H6可知,发生裂解反应后物质的量增加0.6mol,则混合气体的物质的量为1.6mol,此时混合气体平均相对分子质量为58÷1.6=36.25,
故答案为:36.25.
点评 本题考查有机物的结构与性质及原电池,为高频考点,把握官能团与性质的关系、电极反应为解答的关键,侧重分析与应用能力的考查,注意有机物的性质及应用,题目难度不大.


 百年学典课时学练测系列答案
百年学典课时学练测系列答案 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案科目:高中化学 来源: 题型:推断题
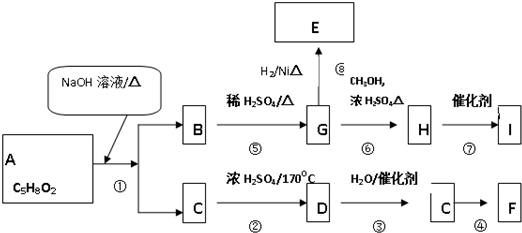
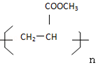
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3O4溶解在过量的稀硝酸中:Fe3O4+8H+═Fe2++2Fe3++4H2O | |
| B. | 向NaAlO2溶液中通入少量CO2:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- | |
| C. | 向AlCl3溶液中加入过量的NH3•H2O:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| D. | 用铜除去CuCl2 溶液中少量的FeCl3:Fe2++Cu═Fe3++Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3-O-CH3 | B. | (CH3)3C-CH2-O-CH3 | ||
| C. | (CH3)3C-CH2-O-CH2-C(CH3)3 | D. | (CH3)2C=CH(CH3) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
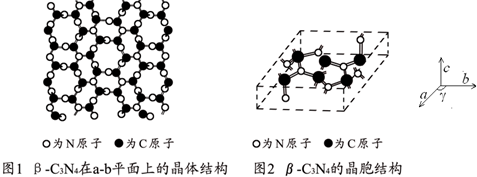
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀硝酸和过量铁屑反应 3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O | |
| B. | 氯化铝溶液和过量的氨水反应 Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| C. | 碳酸钠溶液中加入过量苯酚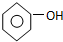 +CO32-→ +CO32-→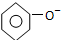 +HCO3- +HCO3- | |
| D. | 次氯酸钙溶液中通入过量CO2 ClO-+CO2+H2O═HClO+HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{(b-a)}{V}$ | B. | $\frac{(2b-a)}{V}$ | C. | $\frac{2(b-a)}{V}$ | D. | $\frac{2(2b-a)}{V}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

组号 | 反应温度 (℃) | 参加反应的物质 | ||||
| Na2S2O3 | H2SO4 | H2O | ||||
| V/ml | c/mol•L-1 | V/ml | c/mol•L-1 | V/ml | ||
| A | 10 | 5 | 0.1 | 10 | 0.1 | 5 |
| B | 10 | 5 | 0.1 | 5 | 0.1 | a |
| C | 30 | 5 | 0.1 | 10 | 0.1 | 5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com