
【题目】实验室里通常用MnO2与浓盐酸反应制取氯气,其反应的化学方程式为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(1)在该反应中,如有1molCl2生成,被氧化的HCl的物质的量是__,转移电子的数目是___。
(2)在反应3Cl2+6KOH(浓)=5KCl+KClO3+3H2O中,氧化产物与还原产物的物质的量之比为___,3molCl2参加该反应时,反应中转移___mol电子。
(3)某温度下,将Cl2通入NaOH溶液中,反应得到含有ClO-与ClO3-物质的量之比为1∶1的混合液,反应的化学方程式是___。
(4)报纸报道了多起卫生间清洗时,因混合使用“洁厕灵”(主要成分是盐酸)与“84消毒液”(主要成分是NaClO)发生氯气中毒的事件。试根据你的化学知识分析,原因是(用离子方程式表示)___。
【答案】2mol 2NA或1.204×1024 1:5 5 4Cl2+8NaOH![]() 6NaCl+NaClO3+NaClO+4H2O Cl-+ClO-+2H+=Cl2↑+H2O
6NaCl+NaClO3+NaClO+4H2O Cl-+ClO-+2H+=Cl2↑+H2O
【解析】
(1)反应MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O中,Cl元素化合价升高的盐酸做还原剂,生成1mol氯气,就有2mol盐酸被氧化,转移电子数目为2NA或1.204×1024,
MnCl2+Cl2↑+2H2O中,Cl元素化合价升高的盐酸做还原剂,生成1mol氯气,就有2mol盐酸被氧化,转移电子数目为2NA或1.204×1024,
故答案为:2;2NA或1.204×1024;
(2)该反应中,氯元素化合价升高生成KClO3,氯元素化合价降低生成KCl,因此氧化产物与还原产物的物质的量之比为1:5;3molCl2参加该反应时,生成1mol KClO3,氯元素化合价从0价升高至+5价,转移5mol电子,
故答案为:1:5;5;
(3)氯气可以和氢氧化钠之间反应,氯元素化合价升高生成氯酸钠、次氯酸钠,根据化合价有升必有降的原理可知,氯元素化合价会降低生成氯化钠,根据原子守恒可知生成物还有水,其方程式为:4Cl2+8NaOH![]() 4H2O+6NaCl+NaClO+NaClO3,
4H2O+6NaCl+NaClO+NaClO3,
故答案为:4Cl2+8NaOH![]() 4H2O+6NaCl+NaClO+NaClO3;
4H2O+6NaCl+NaClO+NaClO3;
(4)混合使用“洁厕灵”(主要成分是盐酸)与“84消毒液”(主要成分是NaClO),由于次氯酸具有氧化性,在酸性环境下能将氯离子氧化为氯气,即Cl-+ClO-+2H+=Cl2↑+H2O,
故答案为:Cl-+ClO-+2H+=Cl2↑+H2O。


科目:高中化学 来源: 题型:
【题目】工业上制备合成气的工艺主要是水蒸气重整甲烷: CH4(g)+H2O(g)CO(g)+3H2(g) ΔH>0,在一定条件下,向体积为1L的密闭容器中充入1 molCH4(g)和1molH2O(g),测得 H2O(g)和 H2(g)的浓度随时间变化曲线如图所示,下列说法正确的是 ( )
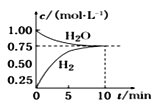
A.达到平衡时,CH4(g)的转化率为75%
B.0~10 min内,v(CO)=0.075 mol·L-1·min -1
C.该反应的化学平衡常数K=0.1875
D.当CH4(g)的消耗速率与H2(g)的消耗速率相等时,反应到达平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】热激活电池可用作火箭、导弾的工作电源。一种热激活电池的基本结钩如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能,此时硫酸铅电极处生成Pb,下列有关说法正确的是( )

A. 输出电能时,外电路中的电子由硫酸铅电极流向钙电极
B. 放电时电解质LiCl-KCl中的Li+向钙电极区迁移
C. 每转0.2mol电子,论上消耗42.5gLiCl
D. 电池总反应为Ca+PbSO4+2LiCl=Pb+Li2SO4+CaCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组研究盐酸被氧化的条件,进行如下实验。
(1)研究盐酸被MnO2氧化。
实验 | 操作 | 现象 |
Ⅰ | 常温下将MnO2和12mol·L-1浓盐酸混合 | 溶液呈浅棕色,有刺激泩气味 |
Ⅱ | 将Ⅰ中混合物过滤,加热滤液 | 生成大量黄绿色气体 |
Ⅲ | 加热MnO2和4mol·L-1稀盐酸混合物 | 无明显现象 |
①已知MnO2呈弱碱性。Ⅰ中溶液呈浅棕色是由于MnO2与浓盐酸发生了复分解反应,化学方程是________ 。
②Ⅱ中发生了分解反应,反应的化学方程式是________ 。
③Ⅲ中无明显现象的原因,可能是c(H+)或c(Cl-)较低,设计实验Ⅳ进行探究:

将实验Ⅲ、Ⅳ作对比,得出的结论是________。
④用下图装置(a、b均为石墨电极)进行实验V:

i. K闭合时,指针向左偏转
ⅱ. 向右管中滴加浓H2SO4至c(H+)≥7mol·L-1,指针偏转幅度变化不大ⅲ.再向左管中滴加浓H2SO4至c(H+)≥7mol·L-1,指针向左偏转幅度增大
将i和ⅱ、ⅲ作对比,得出的结论是________。
(2)研究盐酸能否被氧化性酸氧化。
①烧瓶中放入浓H2SO4,通过分液漏斗向烧瓶中滴加浓盐酸,烧瓶上方立即产生白雾,用湿润的淀粉KI试纸检验,无明显现象。由此得出浓硫酸________(填“能”或“不能”)氧化盐酸。
②向试管中加入3mL浓盐酸,再加入1mL浓HNO3,试管内液体逐渐变为橙色,加热,产生棕黄色气体,经检验含有NO2。
实验 | 操作 | 现象 |
Ⅰ | 将湿润的淀粉KI试纸伸入棕黄色气体中 | 试纸先变蓝,后褪色 |
Ⅱ | 将湿润的淀粉KI试纸伸入纯净Cl2中 | 试纸先变蓝,后褪色 |
Ⅲ | …… | …… |
通过实验Ⅰ、Ⅱ、Ⅲ证明混合气体中含有Cl2,Ⅲ的操作是________。
(3)由上述实验得出:盐酸能否被氧化与氧化剂的种类、________有关。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】①9.8g H2SO4的物质的量为______mol,约含有________个H2SO4 分子
②标准状况下,22.4LH2的质量为__________ g
③将30mL0.5mol/LNaCl溶液加水稀释到500mL,稀释后NaCl溶液的物质的量浓度为__________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯乙烯(![]() )是制造一次性泡沫饭盒的聚苯乙烯的单体,其合成所涉及到的反应如下:
)是制造一次性泡沫饭盒的聚苯乙烯的单体,其合成所涉及到的反应如下:
I.CO2(g)+H2(g)CO(g)+H2O(g)△H1
Ⅱ.![]() (g)
(g) ![]() (g)+H2(g) △H2
(g)+H2(g) △H2
Ⅲ. ![]() (g)+CO2(g)
(g)+CO2(g) ![]()
![]() (g)+CO(g)+H2O(g) △H3
(g)+CO(g)+H2O(g) △H3
(1)T℃时,2L密闭容器中进行的反应Ⅰ,若按投料方式①进行投料,15 min后反应达到平衡,此时CO2的转化率为75%,则0~15 min内平均反应速率υ( H2)= ________;若按投料方式②进行投料,则开始反应速率υ正(H2) ______υ逆(H2)(填“>”“<”或“=”)。

(2)则△H2=____________(用含有△H1和△H3的式子表达)。
(3)研究表明,温度、压强对反应Ⅲ中乙苯平衡转化率的影响如图所示:
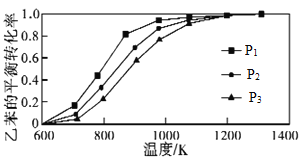
则△H3 ______0(填“>”“<”或“=”);P1、P2、P3从大到小的顺序是 __________ 。
(4)除了改变温度和压强,请提供另外一种可以提高苯乙烯产率的方法__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机反应中,不属于取代反应的是
A.![]() +Cl2
+Cl2![]()
![]() +HCl
+HCl
B.2CH3CH2OH+O2![]() 2CH3CHO+2H2O
2CH3CHO+2H2O
C.ClCH2CH===CH2+ NaOH![]() HOCH2CH===CH2+NaCl
HOCH2CH===CH2+NaCl
D.![]() +HO—NO2
+HO—NO2![]()
![]() +H2O
+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备溴苯的反应装置如下图所示,关于实验操作或叙述错误的是
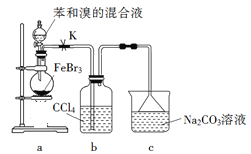
A. 向圆底烧瓶中滴加苯和溴的混合液前需先打开K
B. 实验中装置b中的液体逐渐变为浅红色
C. 装置c中的碳酸钠溶液的作用是吸收溴化氢
D. 反应后的混合液经稀碱溶液洗涤、结晶,得到溴苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对CO2的综合利用可以实现经济社会发展和生态环境保护双赢,对促进低碳社会的构建具有重要意义。回答下列问题:
(1)已知:①C的燃烧热为393.5kJ·mol-1
②H2的燃烧热为286kJmol-1
③H2O(g)=H2O(l) △H=-44.0kJmol-1
则CO2(g)+2H2(g)![]() C(s)+2H2O(g)△H=___kJmol-1。
C(s)+2H2O(g)△H=___kJmol-1。
(2)CO2合成甲醇是碳减排的一种重要方法,向1L恒容密闭容器中加入1molCO2、amolH2,在适当的催化剂作用下,发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H=-48.7kJmol-1。平衡时混合气体中CH3OH的体积分数与氢气的物质的量关系如图1所示。
CH3OH(g)+H2O(g) △H=-48.7kJmol-1。平衡时混合气体中CH3OH的体积分数与氢气的物质的量关系如图1所示。

①有利于该反应自发进行的条件是___(填“低温高压”“高温低压”或“低温低压”)。
②图1中 A、B、C三点对应的体系,CO2的平衡转化率最大的是___(填字母),判断依据是___。
(3)利用 CO2催化加氢制乙烯,反应为 2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g) △H。
C2H4(g)+4H2O(g) △H。
在1L恒容密闭容器中,均加入1molCO2、3molH2,分别选用两种催化剂,反应进行相同时间后,测得CO2转化率[α(CO2)]随反应温度的变化如图2所示。
①使用催化剂Ⅰ时反应的活化能___(填“高于”或“低于”)使用催化剂Ⅱ。
②c、d两点的平衡常数大小关系为:Kc___Kd(填“<”“>”或“=”),判断依据是___。
(4)常温下,可利用碱性溶液吸收CO2。用100mL0.3mol·L-1Na2CO3溶液完全吸收0.88gCO2气体(忽略溶液体积变化)。所得溶液中:c(HCO3-)+c(CO32-)+c(H2CO3)=___molL-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com