
 用3.2g含有一定杂质的镁条与足量的稀硫酸反应制取氢气(杂质不与硫酸反应),收集到氢气2.24L(已折算到标准状况下),再往反应后的溶液中滴加NaOH溶液,使镁元素转化成Mg(OH)2沉淀,发现生成的沉淀质量与加入NaOH溶液中NaOH的物质的量有如图所示关系,试求:
用3.2g含有一定杂质的镁条与足量的稀硫酸反应制取氢气(杂质不与硫酸反应),收集到氢气2.24L(已折算到标准状况下),再往反应后的溶液中滴加NaOH溶液,使镁元素转化成Mg(OH)2沉淀,发现生成的沉淀质量与加入NaOH溶液中NaOH的物质的量有如图所示关系,试求:分析 (1)根据氢气的体积求出物质的量,由方程式计算Mg的物质的量和质量,再求出质量分数;
(2)由图象可知,生成沉淀消耗的氢氧化钠为0.2mol,根据离子方程式计算生成沉淀的物质的量和质量;
(3)当消耗0.4molNaOH时,镁离子全部转化为沉淀,溶液中的溶质为Na2SO4,根据原子守恒计算.
解答 解:(1)已知氢气为2.24L,则n(H2)=$\frac{V}{{V}_{m}}$=$\frac{2.24L}{22.4L/mol}$=0.1mol,
设参加反应的Mg的质量为x
Mg+H2SO4═MgSO4+H2↑
24g 1mol
x 0.1mol
x=$\frac{24g×0.1mol}{1mol}$=2.4g;
含杂质的镁条中镁元素的质量分数为$\frac{2.4g}{3.2g}$×100%=75%;
答:含杂质的镁条中镁元素的质量分数为75%;
(2)由图象可知,生成沉淀消耗的氢氧化钠为0.2mol,
氢氧化钠与硫酸镁的离子方程式为:Mg2++2OH-=Mg(OH)2↓,
则n[Mg(OH)2]=$\frac{1}{2}$n(OH-)=0.1mol,所以生成的Mg(OH)2沉淀的质量为0.1mol×58g/mol=5.8g;
答:生成的Mg(OH)2沉淀的质量为5.8g;
(3)当消耗0.4molNaOH时,镁离子全部转化为沉淀,溶液中的溶质为Na2SO4,则n(H2SO4)=n(Na2SO4)=$\frac{1}{2}$n(NaOH)=0.2mol,
答:原硫酸溶液中硫酸的物质的量为0.2mol.
点评 本题考查了有关方程式的计算,题目难度不大,侧重于考查学生的分析能力和计算能力,注意原子守恒在化学方程式计算中的应用.


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:解答题
 如图是一块用FeCl3溶液与Cu反应制作的印刷电路板,其制作原理可用下式表示:2FeCl3+Cu═CuCl2+2X.
如图是一块用FeCl3溶液与Cu反应制作的印刷电路板,其制作原理可用下式表示:2FeCl3+Cu═CuCl2+2X.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
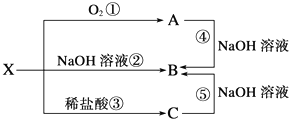
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(H+)=0.1mol/L的溶液:Na+、NH4+、SO42-、S2O32- | |
| B. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1×10-12的溶液:K+、AlO2-、CO32-、Na+ | |
| C. | c(Fe2+)=0.1mol/L的溶液:H+、Al3+、NO3-、SCN- | |
| D. | 在由水电离出的c(H+)=1×10-12mol/L的溶液:Fe3+、ClO-、Na+、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

| 滴定次数 | 待测液体的体积/mL | 标准碱溶液的体积/mL | |
| 滴定前 | 滴定后 | ||
| 第一次 | 20.00mL | 0.00 | 20.98 |
| 第二次 | 20.00mL | 0.22 | 20.20 |
| 第三次 | 20.00mL | 0.36 | 20.38 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④ | B. | ①③⑤ | C. | ①②⑤ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
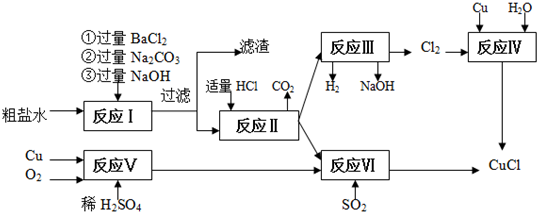
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 甲~己元素在周期表中的相对位置如图.甲是形成化合物种类最多的元素,乙比甲原子序数多6,丁、戊、己属同周期元素,下列判断错误的是( )
甲~己元素在周期表中的相对位置如图.甲是形成化合物种类最多的元素,乙比甲原子序数多6,丁、戊、己属同周期元素,下列判断错误的是( )| A. | 乙的单质在空气中燃烧生成的化合物只含离子键 | |
| B. | 丙可作半导体材料 | |
| C. | 丁与已核外电子数相差12 | |
| D. | 戊和己都不是主族元素,而是过渡元素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com