
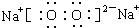 .
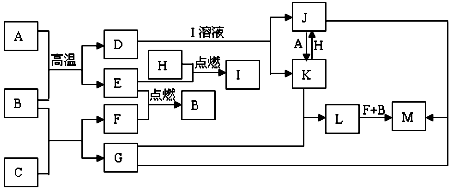
.分析 根据题给信息可知,H是气体单质,呈黄绿色证明是Cl2,B是最常见液体,转化中可以由EF两种气体点燃反应单质生成,可以预测为B为水,G的焰色反应呈黄色说明含有钠元素,M是红褐色沉淀说明是Fe(OH)3;L是白色沉淀,L+F+B→M,证明L是Fe(OH)2;根据K+G→L,推断G为NaOH,K为FeCl2,结合K+H→J可知,J为FeCl3;A是固体单质能发生反应A+J→K是还原三价铁盐为二价铁盐的转化,所以判断A为Fe;根据L+F+B→M是氢氧化亚铁转化为氢氧化铁的反应,所以F为O2,B为H2O,E为H2;E+H→I,H为Cl2,I为HCl;转化关系中D+I→J+K,I是HCl,J是FeCl3,K是FeCl2,推断D为Fe3O4,A(Fe)+B(H2O)→E(H2)+D(Fe3O4);B(H2O)+C→F(O2)+G(NaOH),推断C为Na2O2,结合判断出的各物质和转化关系进行分析判断和解答.
解答 解:(1)依据上述判断,H的化学式为Cl2;C的化学式为Na2O2,过氧化钠是有两个钠离子和一个过氧根离子构成,所以电子式为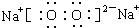 ;故答案为:Cl2;
;故答案为:Cl2;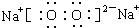
(2)D与I溶液发生的反应为四氧化三铁和盐酸的反应生成氯化铁和氯化亚铁,反应的离子方程式:Fe3O4+8H+=Fe2++2Fe3++4H2O,故答案为:Fe3O4+8H+=Fe2++2Fe3++4H2O
(3)L→M的反应为:L(Fe(OH)2)+B(H2O)+F(O2)→M(Fe(OH)3);化学方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3,故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(4)J是FeCl3;检验Fe3+的方法是利用反应产生的特殊现象进行检验,
A、Fe粉能和三价铁离子反应,其他金属也可以反应,故A不适宜;
B、NaOH溶液和三价铁离子反应生成红褐色沉淀,可以鉴别三价铁离子,故B适宜;
C、KSCN溶液和三价铁离子反应生成血红色溶液,可以鉴别三价铁离子,故C适宜;
故选A.
点评 本题考查了元素化合物的性质转化应用,综合性较大,主要考查铁及其化合物的化学性质的应用,熟练掌握物质的特征反应现象、产物颜色、反应变化等知识是解决问题的关键.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | H2S?2H++S2- | B. | NaHSO4═Na++H++SO42- | ||
| C. | CO32-+2H2O?H2CO3+2OH- | D. | Al3++3H2O?Al(OH)3↓+3H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 营养成分 | 钙 | 磷 | 铁 | 锌 |
| 含量(mg/100g) | 600 | 520 | 6~11 | 3~7 |
| A. | 金属 | B. | 非金属 | C. | 元素 | D. | 分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 编号 | T/K | 大理石规格 | HNO3浓度 |
| ① | 298 | 粗颗粒 | 2.00 mol•L-1 |
| ② | 298 | 粗颗粒 | 1.00 mol•L-1 |
| ③ | 308 | 粗颗粒 | 2.00 mol•L-1 |
| ④ | 298 | 细颗粒 | 2.00 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H1<0△H3>0 | B. | △H5<0△H4<△H3 | C. | △H1=△H2+△H3 | D. | △H3=△H4+△H5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
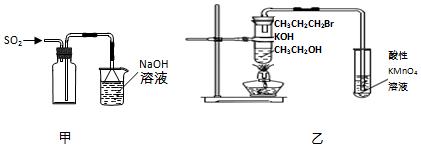
| A. | 用装置甲收集SO2气体 | |
| B. | 用装置乙验证1-溴丙烷发生消去反应是否生成烯烃 | |
| C. | 酸碱中和滴定过程中,眼睛必须注视滴定管刻度的变化 | |
| D. | 配制溶液定容时,俯视容量瓶刻度会使所配溶液的浓度偏高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2FeCO3(s)+$\frac{1}{2}$O2 (g)=Fe2O3(s)+2CO2(g)△H=+130 KJ/mol | |
| B. | 4 FeCO3(s)+O2 (g)=2Fe2O3(s)+4CO2(g)△H=+260 KJ/mol | |
| C. | 4 FeCO3(s)+O2 (g)=2Fe2O3(s)+4CO2(g)△H=-260 KJ/mol | |
| D. | 4 FeCO3(s)+O2 (g)=2Fe2O3(s)+4CO2(g)△H=-260 KJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 实验序号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ | Ⅴ |
| 样本质量(g) | 3.06 | 6.12 | 9.18 | 12.24 | 15.30 |
| Ba(OH)2溶液体积(mL) | 300 | 300 | 300 | 300 | 300 |
| 生成沉淀的质量(g) | 5.19 | 11.82 | 17.73 | 23.64 | 23.64 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
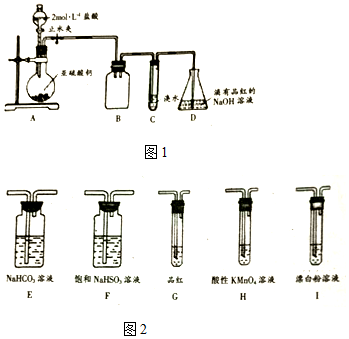
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com