
短周期元素R、T、Q、W在元素周期表中的相对位置如下图所示,其中 T 所处的周期序数与族序数相等。下列判断不正确的是 )。
| R | |||
| T | Q | W |
A.最简单气态氢化物的热稳定性:R>Q
B.最高价氧化物对应水化物的酸性:Q<W
C.原子半径:T>Q>R
D.含T的盐溶液一定显酸性
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
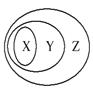
用下图表示的一些物质或概念间的从属关系中不正确的是( )
| X | Y | Z | |
| A | 苯的同系物 | 芳香烃 | 芳香族化合物 |
| B | 胶体 | 分散系 | 混合物 |
| C | 置换反应 | 氧化还原反应 | 离子反应 |
| D | 碱性氧化物 | 金属氧化物 | 氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:反应①Fes)+CO2g)FeOs)+COg)的平衡常数为K1;反应②Fes)+H2Og)FeOs)+H2g)的平衡常数为K2,不同温度下K1、K2的值如表中所示:
| 温度 | K1 | K2 |
| 973 K | 1.47 | 2.38 |
| 1 173 K | 2.15 | 1.67 |
请回答下列问题:
1)从表中数据可以推断:反应①是________填“吸”或“放”)热反应。
2)现有反应CO2g)+H2g)COg)+H2Og),写出该反应的平衡常数K3的数学表达式:________。
3)根据反应①与②,可推导出K1、K2与K3之间的关系式。据此关系式及表中数据,也能推断出反应③是吸热反应还是放热反应。欲使反应③在一定条件下建立的平衡向正反应方向移动,可采用的措施有________填序号)。
A.缩小反应容器容积 B.扩大反应容器容积
C.降低温度 D.升高温度
E.使用合适的催化剂 F.设法减少CO的量
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:
甲醇脱水反应
2CH3OHg)===CH3OCH3g)+H2Og)ΔH1=-23.9 kJ·mol-1
甲醇制烯烃反应
2CH3OHg)===C2H4g)+2H2Og)ΔH2=-29.1 kJ·mol-1
乙醇异构化反应
C2H5OHg)===CH3OCH3g)ΔH3=+50.7 kJ·mol-1
则乙烯气相直接水合反应C2H4g)+H2Og)===C2H5OHg)的ΔH=________kJ·mol-1。
2)[2012·广东理综,314)]碘也可用作心脏起搏器电源——锂碘电池的材料。
该电池反应为:2Lis)+I2s)===2Lis) ΔH
已知:4Lis)+O2g)===2Li2Os) ΔH1
4LiIs)+O2g)===2I2s)+2Li2Os) ΔH2
则电池反应的ΔH=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
能说明元素X原子的得电子能力强于元素Y原子的得电子能力的事实是
)。
A.元素周期表中元素X位于元素Y的上一周期
B.元素X的含氧酸的酸性强于元素Y的含氧酸的酸性
C.分别加热H2X、HY至500 ℃,只有HY发生分解
D.元素X与Y同主族,相同温度时其单质与铜反应分别生成Cu2X和CuY
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示,A池用石墨电极电解pH=13氢氧化钠溶液(100 mL),B池c电极为纯铜,d电极为粗铜(含有杂质Fe、Ag),溶液是足量CuSO4溶液,通电一段时间后停止,A池a极产生的气体在标准状况下为2.24 L,则下列说法正确的是(双选)( )。

A.d电极质量一定减少6.4 g
B.c电极质量一定增加6.4 g
C.A池pH增大
D.A池溶液质量减少3.6 g
查看答案和解析>>
科目:高中化学 来源: 题型:
卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们。
(1)卤族元素位于元素周期表的______区;溴的价电子排布式为________________。
(2)在一定浓度的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的。使氢氟酸分子缔合的作用力是________。
(3)请根据下表提供的第一电离能数据判断,最有可能生成较稳定的单核阳离子的卤素原子是_________(写出名称)。
| 氟 | 氯 | 溴 | 碘 | |
| 第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 |
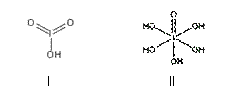 (4)已知碘酸(HIO3)和高碘酸(H5IO6)的结构分别如图I、II所示:
(4)已知碘酸(HIO3)和高碘酸(H5IO6)的结构分别如图I、II所示:
请比较二者酸性强弱:HIO3_____ H5IO6(填“>”、 “<”或“=”)。
(5)已知ClO2-为角型,中心氯原子周围有四对价层电子。ClO2-中心氯原子的杂化轨道类型为___________,写出一个ClO2-的等电子体__________。
 (6)右图为碘晶体晶胞结构。有关说法中正确的是_________。
(6)右图为碘晶体晶胞结构。有关说法中正确的是_________。
A.碘分子的排列有2种不同的取向,2种取向不同的碘分子
以4配位数交替配位形成层结构
 B.用均摊法可知平均每个晶胞中有4个碘原子
B.用均摊法可知平均每个晶胞中有4个碘原子
C.碘晶体为无限延伸的空间结构,是原子晶体
D.碘晶体中存在的相互作用有非极性键和范德华力
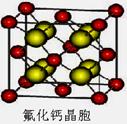
(7)已知CaF2晶体(见右图)的密度为ρg/cm3,NA为阿伏
加德罗常数,棱上相邻的两个Ca2+的核间距为a cm,则CaF2的
相对分子质量可以表示为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关物质氧化性或还原性强弱的叙述错误的是( )
A.Cl2、Br2、I2的氧化性能作为氯、溴、碘元素非金属性递变规律的判断依据[2014·福建理综,23(2)b]
B.同主族元素的简单阴离子还原性越强,水解程度越大(2013·天津理综,3C)
C.将少量溴水加入KI溶液中,再加入CCl4,振荡,静置,可观察到下层液体呈紫色,验证Br2的氧化性强于I2(2014·四川理综,4C)
D.将KI和FeCl3溶液在试管中混合后,加入CCl4,振荡,静置,下层溶液显紫红色,说明氧化性:Fe3+>I2(2014·广东理综,22D)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com