
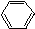
 、
、 ,四种物质的是( )
,四种物质的是( )| A. | H2O | B. | Na2CO3溶液 | C. | 石蕊试液 | D. | NaHSO4溶液 |
分析 CH3COOH、CH3CH2OH、C6H6、C6H5NO2四种物质分别与Na2CO3溶液反应的现象为:有气泡冒出、无现象也不分层、分层后油状液体在上层、分层后油状液体在下层,现象不同,可以鉴别,以此来解答.
解答 解:A.CH3COOH、C2H5OH与水混溶,不能鉴别,故A错误;
B.Na2CO3稀溶液与CH3COOH反应产生气体,与C2H5OH混溶,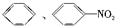 都不溶于水,且苯的密度比水小,硝基苯的密度比水大,可鉴别,故B正确;
都不溶于水,且苯的密度比水小,硝基苯的密度比水大,可鉴别,故B正确;
C.CH3COOH具有酸性,用石蕊试液只能鉴别乙酸,其它物质不反应,无法鉴别,故C错误;
D.CH3COOH、CH3CH2OH与NaHSO4溶液均不反应不分层,现象相同,不能鉴别,故D错误.
故选B.
点评 本题考查有机物的鉴别,注意把握有机物的性质,明确现象不同是鉴别物质的关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 由于水中存在氢键,所以水很稳定 | |
| B. | 能与酸反应生成盐和水的氧化物一定是碱性氧化物 | |
| C. | 单质分子中一定含有共价键 | |
| D. | 由非金属元素组成的化合物不一定是共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2、H2、NH3的百分含量相等 | |
| B. | 单位时间,消耗a mol N2的同时消耗3mol H2 | |
| C. | 单位时间,消耗a molN2的同时生成3a mol H2 | |
| D. | 反应若在定容的密器中进行,压强为反应前的一半 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
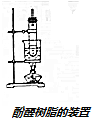 某课外活动小组结合一下材料制酚醛树脂,用苯酚和甲醛为原料,在酸或碱的催化作用下缩聚而成,苯酚过量,在酸性催化剂作用下,缩聚成线型结构的热塑性酚醛树脂,甲醛过量,在碱性催化剂作用下,缩聚成体型结构的热固性酚醛树脂设计实验如下:
某课外活动小组结合一下材料制酚醛树脂,用苯酚和甲醛为原料,在酸或碱的催化作用下缩聚而成,苯酚过量,在酸性催化剂作用下,缩聚成线型结构的热塑性酚醛树脂,甲醛过量,在碱性催化剂作用下,缩聚成体型结构的热固性酚醛树脂设计实验如下: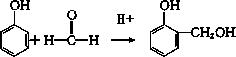
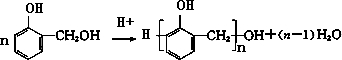
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 分子式:C10H20 | B. | 能使酸性高锰酸钾溶液褪色 | ||
| C. | 能发生加成反应和取代反应 | D. | 所有碳原子均在同一平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(CH3COO-)=c(Cl-)=c(H+)>c(CH3COOH) | B. | c(CH3COO-)=c(Cl-)>c(CH3COOH)=c(H+) | ||
| C. | c(CH3COO-)>c(Cl-)>c(H+)>c(CH3COOH) | D. | c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
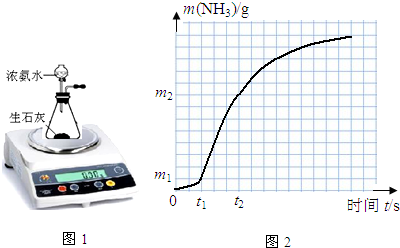
| 实验目的 | V(氨水)/mL | V(H2O)/mL | CaO的状态 | ||
| 实验1 | 实验1和实验2探究固体比表面积、实验1和实验3探究氨水浓度对v(NH3)的影响 | 30 | 粉末状 | ||
| 实验2 | 30 | ||||
| 实验3 | 40 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
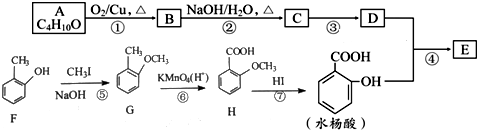
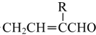
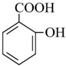 →
→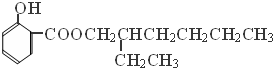 +H2O;
+H2O;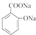
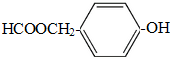 (写结构简式).
(写结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
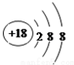
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com