
���� n��C��=n��CO2��=$\frac{8.8g}{44g/mol}$=0.2mol��n��H��=2n��H2O��=2��$\frac{3.6g}{18g/mol}$=0.4mol����֪n��C����n��H��=1��2����A����B������ܶ���2����Bʽ���ȿ�����ƽ��ʽ����С����ʵ��ʽ��A��ͬ����A��B����ʹ������Ȼ�̼��Һ��ɫ��˵��A��B��Ϊϩ����BӦΪCH2=CH2����AΪC4H8��C4H8���ڶ���ͬ���칹�壬�����е���״ͬ���칹��Ľṹ��ʽ��CH3CH2CH=CH2��CH3CH=CHCH3��CH3-C��CH3��=CH2������CH3CH2CH=CH2�������Ϊ2��1��2��3���Դ˽����⣮
��� �⣺��1��n��C��=n��CO2��=$\frac{8.8g}{44g/mol}$=0.2mol��n��H��=2n��H2O��=2��$\frac{3.6g}{18g/mol}$=0.4mol����֪n��C����n��H��=1��2����A����B������ܶ���2����Bʽ���ȿ�����ƽ��ʽ����С����ʵ��ʽ��A��ͬ����A��B����ʹ������Ȼ�̼��Һ��ɫ��˵��A��B��Ϊϩ����BӦΪCH2=CH2����AΪC4H8��
�ʴ�Ϊ��C4H8��CH2=CH2��
��2��AΪC4H8�����ڶ���ͬ���칹�壬�����е���״ͬ���칹��Ľṹ��ʽ��CH3CH2CH=CH2��CH3CH=CHCH3��CH3-C��CH3��=CH2��
�ʴ�Ϊ��A��CH3CH2CH=CH2��CH3CH=CHCH3��CH3-C��CH3��=CH2��
��3��BΪ��ϩ������̼̼˫������������Ȼ�̼��Һ��Ӧ�Ļ�ѧ����ʽΪCH2=CH2+Br2��BrCH2CH2Br��
�ʴ�Ϊ��CH2=CH2+Br2��BrCH2CH2Br��
��4��A��һ��ͬ���칹��˴Ź�������������壬�������Ϊ2��1��2��3��ӦΪCH3CH2CH=CH2�����ڳ����������·�����Ӧ��IJ���ΪHCHO��CH3CH2CHO��
�ʴ�Ϊ��HCHO��CH3CH2CHO��
���� ���⿼���л�����ƶϣ���Ŀ�ѶȲ�����ע������л������ɵĶ�����̼��ˮ�����������Է����������ж��л���ķ���ʽ��ע���л���Ľṹ�ص㣮



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
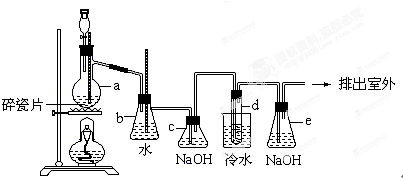
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | NH3 | B�� | PCl3 | C�� | PCl5 | D�� | BCl3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
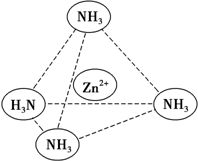 п��һ����Ҫ�Ľ�����п���仯�������Ź㷺��Ӧ�ã�
п��һ����Ҫ�Ľ�����п���仯�������Ź㷺��Ӧ�ã��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | C2H5OH+3O2�T2CO2+3H2O��H=-29.7 kJ/mol | |
| B�� | C2H5OH��l��+3O2 ��g���T2CO2 ��g��+3H 2 O��l����H=-1366.2kJ/mol | |
| C�� | C2 H5 OH��l��+3O2 ��g���T2CO2 ��g��+3H 2O��g����H=+29.7 kJ/mol | |
| D�� | C2H5OH��l��+3O2 ��g���T2CO2 ��g��+3H 2 O��l����H=+1366.2kJ/mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | $\frac{W}{W+18a}$��100% | B�� | $\frac{W}{W+36a}$��100% | C�� | $\frac{W}{161��W+18a��}$��100% | D�� | $\frac{W}{161��W+36a��}$��100% |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���������ܶȲ��ٷ����仯 | |
| B�� | ��λʱ��������nmolN2��ͬʱ����3nmolH2 | |
| C�� | N2��H2��NH3��Ũ�Ȳ��ٷ����仯 | |
| D�� | N2��H2��NH3�����ʵ���֮��Ϊ1��3��2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ⶨͬ�¶�����ͬŨ�ȵ�Na2CO3��Na2SO3��Һ��pH��ǰ�ߴ��ں��ߣ�˵��̼Ԫ�طǽ�����������Ԫ�� | |
| B�� | ��1 mL 1%��NaOH��Һ�м���2 mL 2%��CuSO4��Һ�����ټ���0.5 mL�л���X�����Ⱥ�δ����ש��ɫ������˵��X�в�����ȩ�� | |
| C�� | �����ӵ���Һ�м���Na2CO3��Һ����Һ����壬˵�����ԣ����ӣ�HCO3- | |
| D�� | ��Ũ�Ⱦ�Ϊ0.1 mol•L-1��MgCl2��CuCl2�����Һ����μ��백ˮ������������ɫ������˵��Ksp[Cu��OH��2]��Ksp[Mg��OH��2] |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
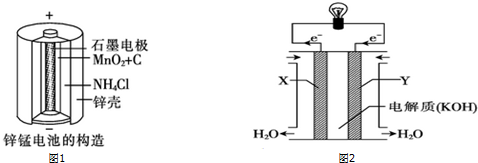
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com