
| A、铝粉投入到NaOH溶液中:2Al+2OH-═2AlO2-+H2↑ |
| B、AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ |
| C、三氯化铁溶液中加入铁粉:Fe3++Fe=2Fe2+ |
| D、氯化铁溶液与氢氧化钠溶液:Fe3++3OH-═Fe(OH)3↓ |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、Ag发生还原反应 |
| B、正极反应式:5MnO2+2e-=Mn5O102- |
| C、每生成1mol AgCl转移2mol电子 |
| D、Cl-不断向“水”电池的正极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电解法精炼铜时,以粗铜作阴极,纯铜作阳极 |
| B、向沸水中滴加FeCl3饱和溶液制备Fe(OH)3胶体 |
| C、常温下,将pH=10的氨水稀释,溶液中所有离子浓度都减小 |
| D、反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,则该反应的△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol?L-1NH4Cl溶液:c(NH4+)=c(Cl-) |
| B、0.1mol?L-1 Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+c(H2CO3) |
| C、向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| D、向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液:c(Na+)=c(NO3-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X的氢化物溶液与其最高价氧化物对应的水化物溶液的酸碱性相反 |
| B、Y的氧化物既可与强酸反应又可与强碱反应,并可用来制作耐火材料 |
| C、X和Z的最高价氧化物对应的水化物的浓溶液都是具有强氧化性的酸 |
| D、Z的氢化物比X的氢化物更稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
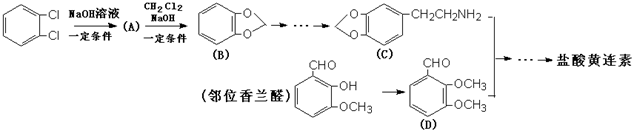
查看答案和解析>>
科目:高中化学 来源: 题型:
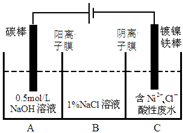 工业上电解法处理含镍酸性废水并得到单质Ni的原理如图所示.下列说法不正确的是( )已知:①Ni2+在弱酸性溶液中发生水解 ②氧化性:
工业上电解法处理含镍酸性废水并得到单质Ni的原理如图所示.下列说法不正确的是( )已知:①Ni2+在弱酸性溶液中发生水解 ②氧化性:| A、碳棒上发生的电极反应:4OH--4e-═O2↑+2H2O |
| B、电解过程中,B中NaCl溶液的物质的量浓度将不断减少 |
| C、为了提高Ni的产率,电解过程中需要控制废水pH |
| D、若将图中阳离子膜去掉,将A、B两室合并,则电解反应总方程式发生改变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com