
改变下列条件,不能使水的电离程度增大的是
| A.加热 |
| B.加入少量的盐酸 |
| C.加入少量的Na2CO3固体 |
| D.加入少量的NH4Cl晶体 |
B
解析试题分析:A.水的电离H2O H++OH-是吸热的,升高温度,水的电离平衡向电离的方向移动,水的电离程度增大。错误。B.加入少量的盐酸时,即增大了H2O
H++OH-是吸热的,升高温度,水的电离平衡向电离的方向移动,水的电离程度增大。错误。B.加入少量的盐酸时,即增大了H2O H++OH-的生成物的浓度,根据平衡移动原理,增大生成物的浓度,平衡向逆反应方向即抑制水电离的方向移动。符合题意,正确。C.加入少量的Na2CO3固体时消耗了H2O
H++OH-的生成物的浓度,根据平衡移动原理,增大生成物的浓度,平衡向逆反应方向即抑制水电离的方向移动。符合题意,正确。C.加入少量的Na2CO3固体时消耗了H2O H++OH-水电离产生的H+,使水电离产生的H+的浓度减小,电离平衡正向移动,最后使水的电离程度增大。不符合题意。错误。D。NH4+会和水电离产生的OH-离子结合产生弱电解质NH3·H2O,破坏了水的电离平衡,水继续电离,最终导致水的电离程度增大,与题干不符合。错误。
H++OH-水电离产生的H+,使水电离产生的H+的浓度减小,电离平衡正向移动,最后使水的电离程度增大。不符合题意。错误。D。NH4+会和水电离产生的OH-离子结合产生弱电解质NH3·H2O,破坏了水的电离平衡,水继续电离,最终导致水的电离程度增大,与题干不符合。错误。
考点:考查外界条件对水的电离平衡的影响的知识。


 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案科目:高中化学 来源: 题型:单选题
设某氨水的pH=X,某盐酸的pH=Y,已知X+Y=14,且X>11,将上述两溶液分别取等体积充分混合,混合液中各离子的浓度由大到小的顺序是
| A.c(Cl-)>c(NH4+)>c(H+) >c(OH-) |
| B.c(NH4+)>c(Cl-)>c(H+)>c(OH-) |
| C.c(NH4+)>c(Cl-)>c(OH-)>c(H+) |
| D.c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列反应中,属于水解反应且书写正确的是
A.CH3COOH+OH- CH3COO-+H2O CH3COO-+H2O |
B.HCO3—+ H2O  CO32- + H3O+ CO32- + H3O+ |
C.NH4+ + H2O  NH3·H2O + H+ NH3·H2O + H+ |
D.S2- + H2O H2S+ OH- H2S+ OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
100mL 0.2 mol/L NH4Cl溶液,测其pH为a。加蒸馏水稀释至1L后,溶液有关变化错误的是
| A.c(NH4Cl)变为0.02mol/L | B.水的电离程度变大 |
| C.n(Cl-)无变化 | D.pH小于a+1 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
取浓度相同的NaOH和HCl溶液,以3∶2体积比相混合,所得溶液的pH等于12,则原溶液的浓度为
| A.0.01 mol·L-1 | B.0.017 mol·L-1 | C.0.05 mol·L-1 | D.0.50 mol·L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
室温下,pH相同体积相同的醋酸和盐酸两种溶液分别采取下列措施,有关叙述正确的是
| A.加适量的醋酸钠晶体后,两溶液的pH均增大 |
| B.使温度都升高20℃后,两溶液的pH均不变 |
| C.加水稀释2倍后,两溶液的pH均减小 |
| D.加足量的锌充分反应后,两溶液产生的氢气一样多 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
一定温度下,甲、乙两瓶氨水的浓度分别为1mol/L和0.1mol/L,则甲、乙两瓶氨水中c(OH—)
之比为
| A.大于10 | B.小于10 | C.等于10 | D.无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
AgCl(s)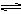 Ag+(aq) + Cl-(aq),平衡时,Ksp =C(Ag+ )·C(Cl-) ,过量氯化银分别投入①100 mL水 ②24 mL 0.1 mol·L-1NaCl ③10 mL 0.1 mol·L-1MgCl2 ④30 mL 0.1 mol·L-1AgNO3溶液中,溶液中C(Ag+)由大到小顺序为
Ag+(aq) + Cl-(aq),平衡时,Ksp =C(Ag+ )·C(Cl-) ,过量氯化银分别投入①100 mL水 ②24 mL 0.1 mol·L-1NaCl ③10 mL 0.1 mol·L-1MgCl2 ④30 mL 0.1 mol·L-1AgNO3溶液中,溶液中C(Ag+)由大到小顺序为
| A.③①②④ | B.④①②③ | C.①②③④ | D.④③②① |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com