
����Ŀ��I������������ת����A��һ�����Σ�D����Է���������C����Է���������16��E���ᣬ��X������ǿ�ỹ��ǿ��ʱ���������µ�ת����ϵ��
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
��X��ǿ��ʱ��A��B��C��D��E����ͬһ��Ԫ�أ���X��ǿ��ʱ��A��B��C��D��E���������ͬһ��Ԫ�ء���ش�
��1��A�Ļ�ѧʽ��______�� Z�ĵ���ʽ��______��
��2����X��ǿ��ʱ��д��C��D�Ļ�ѧ����ʽ��_____��
��3����X��ǿ��ʱ��д��E��ϡ��Һ��ͭ��Ӧ����C�����ӷ���ʽ��_____��
II����FeSO4��Һ�м���(NH4)2SO4������Ʊ�Ħ���ξ���[(NH4)2SO4��FeSO4��6H2O] (����Է�������Ϊ392)���þ����һ���������ȶ������ױ�������������ˮ���������Ҵ���
��4��Ϊ��ϴ��(NH4)2SO4��FeSO4��6H2O�ֲ�Ʒ�����з���������ʵ���____(����ĸ����)��
A������ˮϴ B��������ˮϴ��������ˮ�Ҵ�ϴ
C����30%���Ҵ���Һϴ D����90%���Ҵ���Һϴ
��5��Ϊ�˲ⶨ��Ʒ�Ĵ��ȣ���ȡa g��Ʒ����ˮ�����Ƴ�500mL��Һ����Ũ��Ϊc mol��L-1������KMnO4��Һ�ζ���ÿ����ȡ����Һ�����Ϊ25.00mL��ʵ������¼���£�
ʵ����� | ��һ�� | �ڶ��� | ������ |
���ĸ��������Һ���/mL | 25.52 | 25.02 | 24.98 |
���ϱ��е�һ��ʵ���м�¼�������Դ��ں����Σ���ԭ�������_____(����ĸ����)��
A���ζ�ǰ�ζ��ܼ��������ݣ��ζ�����������
B����һ�εζ��õ���ƿ�ô�װҺ��ϴ����������δ��ϴ
C�������Ը�����ر�Һ����ʱ��������в��ֱ��ʣ�Ũ�Ƚ���
D��ʵ�����ʱ���ӿ̶��߶�ȡ�ζ��յ�ʱ���Ը��������Һ�����
��ͨ��ʵ�����ݼ���ĸò�Ʒ����Ϊ_____(����ĸa��c��ʾ)��
���𰸡� (NH4)2S ![]() 2SO2��O2
2SO2��O2 ![]() 2SO3 3Cu��8H+ ��2NO3�� === 3Cu2+��2NO����4H2O D B
2SO3 3Cu��8H+ ��2NO3�� === 3Cu2+��2NO����4H2O D B ![]() ��100%
��100%
�����������������I�� D����Է���������C�Ĵ�16������һ�������������������ͨ�������ɳ����ж�D��C��һ����ԭ�ӣ���������ת����ϵ���У�SO2��SO3��NO��NO2��Na2SO3��Na2SO4�ȣ��ɴ˿ɳ��ƶ�YΪO2������EΪ�ᣬ��DӦΪ��ת��Ϊ���ij���ʣ��ܿ���ΪSO3��NO2�ȣ���DΪSO3��˳��EΪH2SO4��ZΪH2O������BΪH2S��AΪ�����ʱXΪǿ���DΪNO2��˳��EΪHNO3��ZΪH2O������BΪNH3��AΪ��Σ��ۺ϶���AӦΪ��NH4��2S���Դ˽����⡣
II����4������(NH4)2SO4��FeSO4��6H2O���ܽ���ѡ��ϴ�Ӽ�����5��������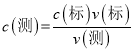 ���� ���ڵ�һ��ʵ���м�¼�������Դ��ں���������һ��ʵ��¼������ȥ���õڶ��Ρ�������ʵ�����ݼ������ĸ��������Һ��������ù�ϵʽ5(NH4)2SO4��FeSO4��6H2O
���� ���ڵ�һ��ʵ���м�¼�������Դ��ں���������һ��ʵ��¼������ȥ���õڶ��Ρ�������ʵ�����ݼ������ĸ��������Һ��������ù�ϵʽ5(NH4)2SO4��FeSO4��6H2O![]() KMnO4 ������ĸò�Ʒ������
KMnO4 ������ĸò�Ʒ������
��������1�������Ϸ�����֪��A�ǣ�NH4��2S��Y��O2��Z��H2O��ˮ�ĵ���ʽ��![]() ����2����X��ǿ��ʱ��E��H2SO4��C����D�Ļ�ѧ����ʽ2SO2��O2
����2����X��ǿ��ʱ��E��H2SO4��C����D�Ļ�ѧ����ʽ2SO2��O2 ![]() 2SO3��
2SO3��
��3����X��ǿ��ʱ��E��HNO3��������ͭ��Ӧ�����ӷ���ʽ��3Cu��8H+ ��2NO3�� === 3Cu2+��2NO����4H2O
II����4�� (NH4)2SO4��FeSO4��6H2O���ױ�������������ˮ���������Ҵ���Ϊ��ֹ(NH4)2SO4��FeSO4��6H2O�ܽ⣬���Ͳ��ʣ���90%���Ҵ���Һϴ��
��5��������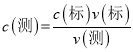 ��A���ζ�ǰ�ζ��ܼ��������ݣ��ζ����������������ĸ��������Һ���ƫС����A������B����һ�εζ��õ���ƿ�ô�װҺ��ϴ����(NH4)2SO4��FeSO4��6H2O�����ʵ���ƫ�����ĸ��������Һ���ƫ��B��ȷ��C�������Ը�����ر�Һ����ʱ��������в��ֱ��ʣ�Ũ�Ƚ��ͣ�Ӧ�ö�����ʵ�鶼��Ӱ�죬��C������D��ʵ�����ʱ���ӿ̶��߶�ȡ�ζ��յ�ʱ���Ը��������Һ��������������ĸ��������Һ���ƫС����D������
��A���ζ�ǰ�ζ��ܼ��������ݣ��ζ����������������ĸ��������Һ���ƫС����A������B����һ�εζ��õ���ƿ�ô�װҺ��ϴ����(NH4)2SO4��FeSO4��6H2O�����ʵ���ƫ�����ĸ��������Һ���ƫ��B��ȷ��C�������Ը�����ر�Һ����ʱ��������в��ֱ��ʣ�Ũ�Ƚ��ͣ�Ӧ�ö�����ʵ�鶼��Ӱ�죬��C������D��ʵ�����ʱ���ӿ̶��߶�ȡ�ζ��յ�ʱ���Ը��������Һ��������������ĸ��������Һ���ƫС����D������
�ڵ�һ��ʵ���м�¼�������Դ��ں���������һ��ʵ��¼������ȥ���õڶ��Ρ�������ʵ�����ݼ������ĸ��������Һ���Ϊ![]() =25.00mL ����ÿ����ȡ����Һ�к�����n mol��
=25.00mL ����ÿ����ȡ����Һ�к�����n mol��
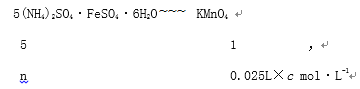
n=0.025L��c mol��L-1��5
��ò�Ʒ����Ϊ0.025L��c mol��L-1��5��20��392g/mol��ag��100%=![]() ��100%��
��100%��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͼ��ʾ���ĸ�װ�ã����н�����ȷ����( )
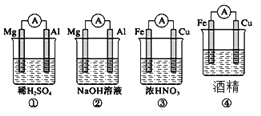
A. �٢���Mg���������ۢ�)��Fe������
B. ����Mg���������缫��ӦΪ6H2O��6e��===6OH����3H2��
C. ����Fe���������缫��ӦΪFe��2e��===Fe2��
D. ����Fe���������缫��ӦΪFe��2e��===Fe2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��ij��Ӧ�����е������仯��ͼ��ʾ��
д���÷�Ӧ���Ȼ�ѧ����ʽ��________________________________��
��2���ϳɰ���ҵ�Թ��ú���ᷢչ������Ҫ�����塣��ԭ��Ϊ��N2(g)��3H2(g)![]() 2NH3(g) ��H����92.4 kJ/mol���ݴ˻ش��������⣺
2NH3(g) ��H����92.4 kJ/mol���ݴ˻ش��������⣺
�ٸ÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽΪK��________��
�ڸ����¶ȶԻ�ѧƽ���Ӱ����ɿ�֪�����ڸ÷�Ӧ���¶�Խ�ߣ���ƽ�ⳣ����ֵ_______������������������С����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����2 L�ĺ����ܱ������г���A(g)��B(g)��������Ӧ��A(g)��B(g) ![]() 2C(g)��D(s)����H��a kJ��mol��1ʵ�����ݺͽ���ֱ������ͼ��ʾ������˵����ȷ����(����)
2C(g)��D(s)����H��a kJ��mol��1ʵ�����ݺͽ���ֱ������ͼ��ʾ������˵����ȷ����(����)
ʵ�� ��� | �¶� | ��ʼ���ʵ��� | ���� �仯 | |
A | B | |||
�� | 600�� | 1 mol | 3 mol | 96 kJ |
�� | 800�� | 1.5 mol | 0.5 mol | ____ |
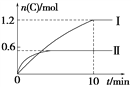
A. ʵ�����У�10 min��ƽ������v(B)��0.06 mol��L��1��min��1
B. ��������ʽ��a��160
C. 600��ʱ���÷�Ӧ��ƽ�ⳣ����0.45
D. ��ʵ������ƽ����ϵ���ٳ���0.5 mol A��1.5 mol B��A��ת��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
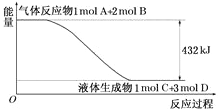
����Ŀ����1��2SO2(g)+O2(g)![]() 2SO3(g)��Ӧ���̵������仯��ͼ��ʾ����֪1 mol SO2(g)����Ϊ1 mol SO3(g)����H= 99 kJ/mol��
2SO3(g)��Ӧ���̵������仯��ͼ��ʾ����֪1 mol SO2(g)����Ϊ1 mol SO3(g)����H= 99 kJ/mol��

��ش��������⣺
��ͼ��A���ʾ��__________________________��
C���ʾ��______________________________��
E�Ĵ�С�Ը÷�Ӧ�ķ�Ӧ��______(����������������)Ӱ�졣
��25����101 kPa�²�ã�2mol SO2��1 mol O2��ַ�Ӧ�ų�����________198 kJ��������������������������С��������
��2����������������Ӧ����1 molˮ�������ų�241��8 kJ����(25����101 kPa�²��)
��д���÷�Ӧ���Ȼ�ѧ����ʽ��_____________________________��
����1 molˮ����ת��ΪҺ̬ˮ����45kJ����ӦH2(g)��![]() O2(g)
O2(g)![]() H2O( l )����H =________________kJ/mol��
H2O( l )����H =________________kJ/mol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ����( )
A.������Һ��ϴ���ۣ����ȿ���ǿ��ȥ������
B.�Ŵ��������մɲ;ߡ����������ש�����ò���Ϊ�����β���
C.�۱�ϩ������һ�ָ���ˮ����֬
D.���͡�ú�͡�ֲ���Ͷ����ͣ������ǵ���Ҫ�ɷֲ���ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��д��ȷ����
A. NaHCO3��Һ�еμӴ��CO32- + 2H����H2O + CO2��
B. ��Ƭ�ϵμ�FeCl3��Һ��Fe + Fe3+��2Fe2+
C. AlCl3��Һ�м��백ˮ��Al3+ + 3NH3H2O��Al(OH)3��+ 3NH4+
D. ����ͨ��NaOH��Һ�У�Cl2 + OH����Cl�� + ClO�� + H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪H2SO3��I2��H2O == H2SO4��2HI����0.1mol Cl2ͨ��100mL�������ʵ�����HI��H2SO3�Ļ����Һ������һ���HI��������������˵����ȷ����
A. ���ʵĻ�ԭ����HI��H2SO3��HCl
B. H2SO3�����ʵ���Ũ��Ϊ0.6 mol��L��1
C. ����ͨ��0.05mol Cl2��ǡ���ܽ�HI��H2SO3��ȫ����
D. ͨ��0.1mol Cl2������Ӧ�����ӷ���ʽΪ��5Cl2��4H2SO3��2I����4H2O == 4SO42����I2��10Cl����16H��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ������������У�SO2�ڽӴ����б�������ΪSO3���壬��֪�÷�ӦΪ���ȷ�Ӧ���ֽ�2 mol SO2��1 mol O2����һ�ܱ�������ַ�Ӧ�ų�����98��3 kJ����ʱ���SO2��ת����Ϊ50%���������Ȼ�ѧ����ʽ��ȷ����
A. 2SO2(g)��O2(g)![]() 2SO3(g) ��H����196��6 kJ��mol��1
2SO3(g) ��H����196��6 kJ��mol��1
B. 2SO2(g)��O2(g)![]() 2SO3(g) ��H����98��3 kJ��mol��1
2SO3(g) ��H����98��3 kJ��mol��1
C. SO2(g)��![]() O2(g)
O2(g)![]() SO3(g) ��H����98��3 kJ��mol��1
SO3(g) ��H����98��3 kJ��mol��1
D. SO2(g)��![]() O2(g)
O2(g)![]() SO3(g) ��H����196��6 kJ��mol��1
SO3(g) ��H����196��6 kJ��mol��1
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com