
下列各表述与示意图一致的是
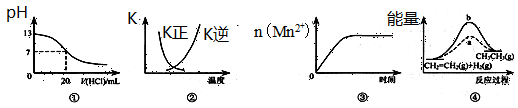
| A.图①表示25℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1 NaOH溶液,溶液的pH随加入酸体积的变化 |
B.图②中曲线表示反应2SO2(g) + O2(g)  2SO3(g);ΔH<0 正、逆反应的平衡常数K随温度的变化 2SO3(g);ΔH<0 正、逆反应的平衡常数K随温度的变化 |
| C.图③表示10 mL 0.01 mol·L-1 KMnO4酸性溶液与过量的0.1 mol·L-1 H2C2O4溶液混合时,n(Mn2+) 随时间的变化 |
| D.图④中a、b曲线分别表示反应CH2=CH2 (g) + H2(g)→CH3CH3(g);ΔH<0使用和未使用催化剂时,反应过程中的能量变化 |
B
解析试题分析:根据图象中纵横坐标的含义,利用点、线来分析一个量发生变化随另外一个量如何变化,若变化趋势与图象中变化趋势一致,即为正确答案。A、0.1mol?L-1NaOH溶液的pH为13,用0.1mol?L-1盐酸滴定恰好中和时pH为7,由于浓度相同,则体积相同。但酸碱中和在接近终点时,pH会发生突变,曲线的斜率会很大,故A错误;B、由于反应为放热反应,则升高温度,平衡逆向移动。所以平衡后升高温度K逆减小,而K正增大,且正逆反应的平衡常数互为倒数关系,故B正确;C、由于反应中生成的Mn2+对该反应能起催化剂的作用,从而使反应速率加快,因此与图像不符,C不正确;D、由于该反应是放热反应,所以反应物的总能量高于生成物的总能量,但图象描述的反应物的总能量低于生成物的总能量,因此D错误,答案选B。
考点:考查中和滴定、平衡常数、反应热等有关图像的分析与判断


科目:高中化学 来源: 题型:单选题
下列有关热化学方程式的叙述中,正确的是
| A.含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则表示该反应中和热的热化学方程式为NaOH(aq)+HCl(aq)=NaC1(aq)+H2O(1) ΔH=+57.4kJ/mo1 |
| B.已知C(石墨,s)=C(金刚石,s) ΔH>0,则石墨比金刚石稳定 |
| C.已知2H2(g)+O2(g)=2H2O(g) ΔH =—483.6kJ/mol,则H2燃烧热为241.8kJ/mol |
| D.己知2C(s)+2O2(g)=2CO2(g) ΔH 1;2C(s)+O2(g)="2CO(g)" ΔH 2;则ΔH 1<ΔH 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
知:① 2C(已s)+O2(g) =2CO(g)  H= -221.0kJ/mmol
H= -221.0kJ/mmol
②2H2(g) + O2(g) =2H2O(g)  H= -483.6kJ/ol。
H= -483.6kJ/ol。
则制备水煤气的反应 C(s) +H2O(g) = CO(g) + H2(g)的 H为
H为
| A.+262.6kJ/mol | B.-131.3kJ/mol | C.-352.3kJ/mol | D.+131.3kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
如下图所示,△H1=-393.5 kJ?mol-1,△H2=-395.4 kJ?mol-1,下列说法正确的是
| A.1 mol石墨的总键能比1 mol金刚石的总键能小1.9 kJ |
| B.石墨和金刚石的转化是物理变化 |
| C.金刚石的稳定性强于石墨 |
| D.C(s、石墨)==C(s、金刚石) △H=" +1.9" kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知:H+(aq)+OH-(aq) =H2O(l); △H=-57.3 kJ·mol-1。现将一定量的稀盐酸、浓硫酸、稀醋酸分别和1L 1mol·L-1的NaOH溶液恰好完全反应,其反应热分别为△H1、△H2、△H3,,则△H1、△H2和△H3的大小关系为
| A.△H1=△H2 | B.△H2>△H1 |
| C.△H3>△H2 | D.△H1>△H3 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列有关反应热的说法正确的是( )
| A.任何强酸与强碱反应生成1 mol H2O的过程中,放出的热量均相同 |
| B.等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 |
| C.对于任何一个吸热反应,使用催化剂后,ΔH将降低 |
| D.已知:O=O键键能为a kJ/ mol、H-H键键能为b kJ/ mol、水蒸气中H-O键能为c kJ/ mol。又知:H2O(g)= H2O(l)ΔH=" -d" kJ/ mol。则反应2H2 (g) + O2(g) = 2H2O(l) 的ΔH为:(a+2b-4c-2d)kJ/ mol |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知H2O(g)= H2O(l) △H1=Q1 kJ/mol
C2H5OH(g) = C2H5OH(l), △H2=Q2 kJ/mol
C2H5OH(g)+3O2(g) =2CO2(g) + 3H2O(g), △H3=Q3 kJ/mol
若使用23 g酒精液体完全燃烧,最后恢复到室温,则放出的热量为( )kJ
| A.Q1 +Q2 +Q3 | B.0.5(Q1 +Q2 +Q3) |
| C.0.5Q1 –0.5Q2 +0.5Q3 | D.1.5Q1 –0.5Q2 +0.5Q 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列与化学反应能量变化相关的叙述正确的是( )
| A.生成物总能量一定低于反应物总能量 |
| B.放热反应的反应速率总是大于吸热反应的反应速率 |
| C.应用盖斯定律,可计算某些难以直接测量的反应焓变 |
| D.同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
强酸与强碱在稀溶液中发生中和反应的热化学方程式为H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1,向3份同体积0.2 mol ·L-1的NaOH溶液中分别加入适量的稀醋酸、浓硫酸、稀硝酸,恰好完全反应的热效应ΔH1、ΔH2、ΔH3的关系正确的是 ( )
| A.ΔH1>ΔH2>ΔH3 | B.ΔH2>ΔH3>ΔH1 |
| C.ΔH2>ΔH1>ΔH3 | D.ΔH1>ΔH3>ΔH2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com