
分析 元素周期表中的递变规律:同周期元素的原子,从左到右,元素的金属性减弱,非金属性增强;氢化物稳定性增强;原子半径逐渐减小;最高价氧化物对应水化物的酸性逐渐增强;从下到上,元素的金属性减弱,非金属性增强;氢化物稳定性增强;原子半径逐渐减小;最高价氧化物对应水化物的酸性逐渐增强,以此解答该题.
解答 解:(1)与水反应最剧烈的金属是位于左下角的金属,在原子序数1-18号元素中应该是Na,故答案为:Na;
(2)与水反应最剧烈的非金属单质是位于最右上角的非金属单质,在原子序数1-18号元素中为F2,故答案为:F2;
(3)气态氢化物最稳定的物质位于周期表的最右上方,化学式是HF,故答案为:HF;
(4)周期表中,从下到上,最高价氧化物对应水化物的酸性逐渐增强,同周期元素的原子,从左到右,最高价氧化物对应水化物的酸性增强,所以最高价氧化物对应水化物的酸性最强的酸是高氯酸,故答案为:HClO4.
点评 本题考查学生元素周期表中的递变规律,为高频考点,侧重考查学生的分析能力,注意知识的归纳和整理是解题的关键,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 1mol葡萄糖能水解生成2molCH3CH2OH和2molCO2 | |
| B. | 在鸡蛋清溶液中分别加入饱和Na2SO4、CuSO4溶液,都会因盐析产生沉淀 | |
| C. | 欲检验蔗糖水解产物是否具有还原性,可向水解后的溶液中直接加入新制的Cu(OH)2并加热 | |
| D. | 油脂不是高分子化合物,1mol油脂完全水解生成1mol甘油和3mol高级脂肪酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
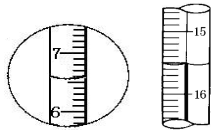
| A. | 左边是量筒读数6.5mL,右边是滴定管读数16.50mL | |
| B. | 左边是量筒读数7.5mL,右边是滴定管读数16.50mL | |
| C. | 左边是量筒读数6.5mL,右边是滴定管读数15.50mL | |
| D. | 左边是量简读数6.5mL,右边是滴定管读数16.50mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 一定温度下,在2L的密闭容器中发生如下反应:A(s)+2B(g)?2C(g)△H<0,反应过程中B、C的物质的量随时间变化的关系如图1;反应达平衡后在t1、t2、t3、t4时分别都只改变了一种条件,逆反应速率随时间变化的关系如图2,下列有关说法正确的是( )
一定温度下,在2L的密闭容器中发生如下反应:A(s)+2B(g)?2C(g)△H<0,反应过程中B、C的物质的量随时间变化的关系如图1;反应达平衡后在t1、t2、t3、t4时分别都只改变了一种条件,逆反应速率随时间变化的关系如图2,下列有关说法正确的是( )| A. | 反应开始2min内,v(A)=0.025mol/(L•mol) | |
| B. | t1时改变的条件可能是升高温度 | |
| C. | t3时改变的条件可能是加压,此时c(B)不变 | |
| D. | t4时可能是使用了催化剂,此时c(B)不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将Cl2与HCl混合气体通过饱和食盐水可得到纯净的Cl2 | |
| B. | 向FeCl2溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中含有HClO | |
| C. | SiO2既能和氢氧化钠溶液反应也能和氢氟酸反应,所以是两性氧化物 | |
| D. | 将浓硫酸滴到蔗糖表面,固体变黑膨胀,说明浓硫酸有脱水性和强氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
| 钒沉淀率/% | 88.1 | 91.8 | 96.5 | 98 | 99.8 | 9.8 | 96.4 | 93.0 | 89.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | A可以形成+1价阳离子 | B. | B的最高价为+6价 | ||
| C. | Z一定可以与水反应 | D. | Z中不可能含有共价键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com