
【题目】在水溶液中,重铬酸钾K2Cr2O7存在以下平衡:Cr2O72-+H2O![]() 2CrO42-+2H+,下列说法正确的是( )
2CrO42-+2H+,下列说法正确的是( )
A.向该溶液中加入过量浓NaOH溶液后,溶液呈橙红色
B.该反应是氧化还原反应
C.向该溶液中滴加适量的浓硫酸,平衡向逆反应方向移动,再次达到平衡后,氢离子浓度比原溶液大
D.该反应的平衡常数表达式是K=c2(CrO42-)c2(H+)/c(Cr2O72-)c(H2O)
 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:
【题目】根据下列图示所得出的结论不正确的是( )
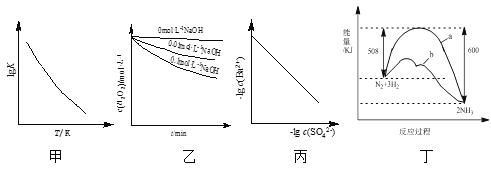
A.图甲是CO(g)+H2O(g)![]() CO2(g)+H2(g)的lgK与反应温度T的关系曲线,说明该反应的ΔH<0
CO2(g)+H2(g)的lgK与反应温度T的关系曲线,说明该反应的ΔH<0
B.图乙是70℃时不同pH条件下H2O2浓度随时间的变化曲线。说明其他条件相同时,溶液pH越小,H2O2分解速率越快
C.图丙是室温下用Na2SO4除去溶液中Ba2+达到沉淀溶解平衡时,溶液中c(Ba2+)与c(SO![]() )的关系曲线,说明溶液中c(SO
)的关系曲线,说明溶液中c(SO![]() )越大c(Ba2+)越小
)越大c(Ba2+)越小
D.图丁是合成氨反应过程中能量变化曲线,说明该反应为放热反应,且b表示在反应体系中加入了催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是分离混合物时常用的仪器,可以进行的混合物分离操作分别是()
![]()
A.蒸馏、过滤、萃取、蒸发B.蒸馏、蒸发、萃取、过滤
C.萃取、过滤、蒸馏、蒸发D.过滤、蒸发、萃取、蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
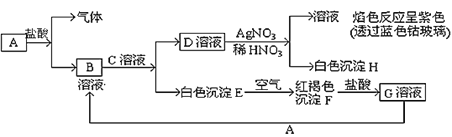
【题目】某溶液中含有Ba2+,Cu2+,Ag+,现用NaOH溶液、盐酸和Na2SO4溶液将这三种离子逐一沉淀分离。其流程图如右
(1)沉淀的化学式:沉淀1___________,沉淀2__________,沉淀3____________;
(2)写出混合液+A的离子方程式________________________________________;
溶液+B的离子方程式_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】JohnB.Goodenough等三位科学家因为在锂离子电池研究领域的突出贡献获得2019年诺贝尔化学奖。碳酸锂是一种常见的锂离子电池原料,一种以锂辉石为原料制取碳酸锂的工艺如图:(锂辉石:LiAl(SiO3)2,也表示为Li2O·Al2O3·4SiO2,还含微量的钠、钙、镁等元素)

[查阅资料]:Li2CO3为无色单斜晶系结晶体,熔点618℃,溶于硫酸,微溶于水,在冷水中的溶解度比热水中大。
(1)在“硫酸浸出”流程,将硫酸加热到130℃的目的是___________________________。
(2)工业上高温煅烧FePO4、Li2CO3和草酸晶体(H2C2O4·2H2O)的混合物制取电池材料磷酸亚铁锂(LiFePO4),反应的化学方程式为__________________________________。
(3)LiFePO4含有Fe、Li两种金属元素,它们的焰色反应的颜色分别是___________
A.黄色、紫红色B.绿色、黄色C.无焰色反应、紫红色D.黄色、无焰色反应
(4)在“Li2CO3分离、洗涤”流程,用热水洗涤的原因是___________________________。
(5)某浓差电池的原理示意如图所示,可用该电池从浓缩海水中提取LiCl溶液。

电池中的Y电极为________(填“正极”或“负极”或“阳极”或“阴极”)。X极的电极反应方程式为:________________________________________________。Y极每生成标况下22.4LCl2,有_________molLi+经过离子导体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠、铝和铁是三种重要的金属。请回答:
(1)当前,产量最高,用途最广的金属是_____________。
(2)这三种金属的金属活动性由强到弱的顺序是_______________ 。
(3)硫酸铁有净水的作用。写出硫酸铁的电离方程式:_____________ 。
(4)小块金属钠投入水中,发生反应的化学方程式为_____________;可观察到的实验现象是_____(填字母)。
a.钠沉到水底 b.钠熔成小球 c.小球四处游动d.水变红色
(5)足量的铝与氢氧化钠溶液反应后得到标准状况下的氢气2.24L,则参加反应的铝的质量为_____ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有以下物质相互转化关系:
试回答:
(1)写出各物质的化学式A________________、D___________、F_______ 。
(2)检验G溶液中阳离子所选用的试剂是_______(写化学式),实验现象是______。
(3)写出B溶液与C溶液反应的化学方程式___________________________ 。
(4)写出G溶液与A反应的离子反应方程式___________________________ 。
(5)上图中共有6个化学反应,其中属于氧化还原反应的有几个?________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分是Al2O3,还有少量的Fe2O3、SiO2)提取冶炼铝的原料氧化铝,工艺流程如图:
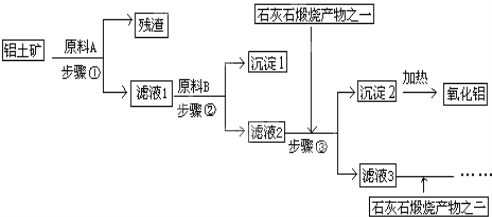
(1)原料A的名称是______,步骤①反应的离子方程式是__________、 ________;
(2)滤液1中要加入稍过量原料B,原料B的化学式是______,步骤②反应的子方程式是:________________、 ____________、 _____________;
(3)步骤③主要的化学方程式是:_________;
(4)滤液3中的离子主要有______, 该流程中哪些物质可循环使用_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
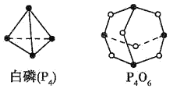
【题目】(1)化学反应可视为旧键断裂和新键形成的过程,化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量,已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键能:P-P:198kJ·mol-1,P-O:360 kJ·mol-1,O=O:498kJ·mol-1,则反应P4(白磷)与O2反应生成P4O6的热化学反应方程式为____。
(2)肼(N2H4)可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气。已知:
①N2(g)+2O2(g)═N2O4(l) △H1═-19.5kJ/mol
②N2H4(l)+O2(g)═N2(g)+2H2O(g) △H2═-534.2kJ/mol
写出肼和N2O4反应的热化学方程式_____。
(3)化学反应N2+3H2![]() 2NH3的能量变化如图所示,该反应生成NH3(l)的热化学方程式是_____。
2NH3的能量变化如图所示,该反应生成NH3(l)的热化学方程式是_____。
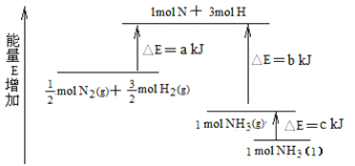
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com