
| 阳离子 | Al3+、Ba2+ |
| 阴离子 | OHˉ、SO42ˉ、Clˉ |
| A. | 往甲和乙的混合溶液中加入过量的丁溶液一定会生成白色沉淀 | |
| B. | 丙和丁的水溶液混合后会生成白色沉淀 | |
| C. | 一定温度下,丙溶于水会使水的电离程度增大 | |
| D. | 一定温度下,甲溶于水会使水的电离程度减小 |
分析 表中6种离子形成的易溶于的化合物有:Al2(SO4)3、AlCl3、Ba(OH)2、BaCl2,用pH试纸检测得知甲、乙两种水溶液呈酸性,丙的水溶液呈中性,丁的水溶液呈碱性,则甲乙为Al2(SO4)3、AlCl3,丙为BaCl2,丁为Ba(OH)2,据此对各选项进行判断.
解答 解:表中离子形成的易溶于的化合物有:Al2(SO4)3、AlCl3、Ba(OH)2、BaCl2,用pH试纸检测得知甲、乙两种水溶液呈酸性,丙的水溶液呈中性,丁的水溶液呈碱性,则甲、乙为Al2(SO4)3、AlCl3,丙为BaCl2,丁为Ba(OH)2,
A.甲、乙为Al2(SO4)3、AlCl3,丁为Ba(OH)2,往Al2(SO4)3、AlCl3的混合溶液中加入过量的Ba(OH)2溶液一定会生成硫酸钡白色沉淀,故A正确;
B.丙为BaCl2,丁为Ba(OH)2,二者混合不会生成沉淀,故B错误;
C.丙为BaCl2,氯离子和钡离子不影响水的电离,故C错误;
D.甲溶液中含有铝离子,铝离子计算促进了水的电离,故D错误;
故选A.
点评 本题考查了常见离子的性质及推断,题目难度中等,推断物质组成为解答关键,注意掌握常见离子的性质为解答关键,试题有利于提高学生的分析能力及逻辑推理能力.


科目:高中化学 来源: 题型:选择题
| A. | 将塑料废弃物加工成防水材料或汽油,变废为宝 | |
| B. | 煤燃烧产生的烟气直接排放到空气中,易造成水体的富营养化 | |
| C. | 食品添加剂必须用天然物质制造 | |
| D. | 乙醇、过氧化氢、次氯酸钠等消毒液均可以将病毒氧化而达到消毒的目的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定温度和压强下,各种气态物质体积的大小,由构成气体的分子大小决定 | |
| B. | 不同的气体,若体积相同,则它们所含的分子数必相同 | |
| C. | 气体的摩尔体积是指1mol任何气体所占的体积都是22.4L | |
| D. | 恒温恒压条件下,反应前后气体的体积之比等于气体的物质的量之比 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学计量数x=2 | B. | M的转化率为41.67% | ||
| C. | N的平衡浓度为0.075mol/L | D. | 反应前后混合气体的压强比为$\frac{23}{22}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
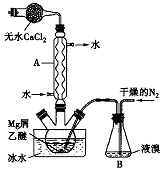 无水MgBr2可用作催化剂.实验室采用镁屑与液溴为原料制备无水MgBr2,装置如图所示(夹持仪器略去).主要步骤如下:
无水MgBr2可用作催化剂.实验室采用镁屑与液溴为原料制备无水MgBr2,装置如图所示(夹持仪器略去).主要步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:推断题
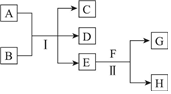 A~H为中学化学中几种常见物质,它们之间的转化关系如图所示.常温下,A和G均为单质气体,同体C常用作干燥剂,E为无色、无味的液体,F为淡黄色粉末.回答下列问题:
A~H为中学化学中几种常见物质,它们之间的转化关系如图所示.常温下,A和G均为单质气体,同体C常用作干燥剂,E为无色、无味的液体,F为淡黄色粉末.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Q、R的最高价氧化物对应水化物间可反应 | |
| B. | Y的简单氢化物比Z的简单氢化物稳定 | |
| C. | 可通过电解熔融氯化物的方法制备Q、R | |
| D. | X元素单质在化学反应中只表现还原性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com