
分析 20%的硫酸400g,可知m(H2SO4)=20%×400g=80g,设需98%、密度1.84g.cm-3的浓硫酸的体积为xmL,则有1.84x×98%=80g,以此解答.
解答 解:20%的硫酸400g,可知m(H2SO4)=20%×400g=80g,
设需98%、密度1.84g.cm-3的浓硫酸的体积为xmL,则有1.84x×98%=80g,x=44.37mL,浓硫酸的质量为44.37mL×1.84g/mL=81.6g,
需要水的质量为400g-81.6g=318.4g,
体积为0.3184L,
答:配制20%的硫酸400g,需98%、密度1.84g.cm-3的浓硫酸44.37毫升,水0.3184升.
点评 本题考查溶液质量分数的计算,为高频考点,侧重于学生的分析、计算能力的考查,注意把握相关计算公式的运用,理清做题的思路,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 三氯化铁溶液中加入铁粉:Fe3++Fe═2Fe2+ | |
| B. | 苯酚钠溶液中通入少量CO2:CO2+H2O+C6H5O-→C6H5OH+HCO3- | |
| C. | AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ | |
| D. | 用浓盐酸与MnO2反应制取少量氯气:MnO2+4H++4Cl-═Mn2++Cl2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤ | B. | ②③④ | C. | ①③⑤ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
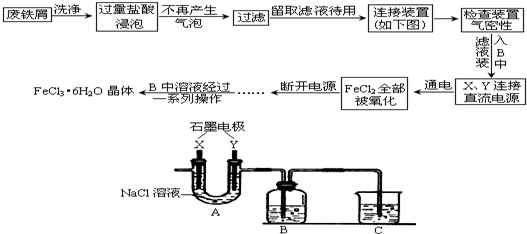
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t/s | 0 | 50 | 100 |
| c(N2O5)/mol•L-1 | 5.0 | 3.5 | 2.4 |
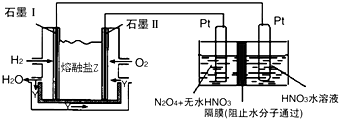
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子总数为NA的NO2和CO2混合气体中含有的氧原子数为2NA | |
| B. | 28g乙烯(C2H4)和环丁烷(C4H8)的混合气体中含有的碳原子数为2NA | |
| C. | 常温常压下,92g的NO2和N2O4混合气体含有的原子总数为6NA | |
| D. | 17gOH-中含有的质子数为10NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com