
| A. | 反应中转移电子为0.04 mol | B. | Q中n(Cu2+):n(Fe2+)=1:2 | ||
| C. | 溶液Q比原溶液增重了 1.28 g | D. | 3c(Fe3+)+2c(Fe2+)+2c(Cu2+)=0.1 mol/L |
分析 反应的离子方程式为2Fe3++Cu=2Fe2++Cu2+,
设反应生成的c(Fe2+)=xmol/L,
设有生成xmolFe2+,
2Fe3++Cu=2Fe2++Cu2+
2 2 1
x x $\frac{1}{2}$x
根据c(Fe3+):c(Fe2+)=2:3计算,结合电荷守恒分析.
解答 解:设有生成xmolFe2+,
2Fe3++Cu=2Fe2++Cu2+
2 2 1
x x $\frac{1}{2}$x
反应后c (Fe3+):c(Fe2+)=(0.1-x):x=2:3,
则x=0.06mol,
由方程式可知:生成的Cu2+的物质的量为 $\frac{1}{2}$x=0.03mol/L,
A.溶液体积未知,不能计算转移的电子的物质的量,故A错误;
B.Q中n(Cu2+):n(Fe2+)=0.03:0.06=1:2,故B正确;
C.但溶液体积未知,不能计算参加反应的Cu的物质的量,即不能计算铜的质量,所以溶液的质量增加了多少无法计算,故C错误;
D.忽略水解,由电荷守恒可知,3c(Fe3+)+2c(Fe2+)+2c(Cu2+)=c(Cl-)=0.3mol/L,故D错误;
故选B.
点评 本题考查离子反应的计算,利用假设法可计算离子浓度的关系,侧重分析能力及计算能力的考查,注意溶液的体积未知,选项BC为解答的易错点,题目难度中等.


科目:高中化学 来源: 题型:选择题
| 化学键 | C-H | C=C | C-C | H-H |
| 键能(kJ•mol1) | 414.4 | 615.3 | 347.4 | 435.3 |
| A. | +125.6 kJ•molˉ1 | B. | -125.6 kJ•molˉ1 | C. | +46.1 kJ•molˉ1 | D. | -46.1 kJ•molˉ1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
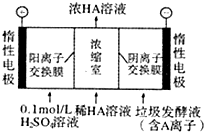 对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施之一.
对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施之一.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0 L 1.0 mo1•L-1的NaAlO2 水溶液中含有的氧原子数为2 NA | |
| B. | 含有NA个原子的氢气在标准状况下的体积约为22.4 L | |
| C. | 标准状况下,2.24 LCl2与足量水反应转移的电子数为0.2NA | |
| D. | V L a mol•L-1的氯化铁溶液中,若Fe3+的数目为NA,则Cl-的数目大于3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 摩尔是把物质的质量和微观粒子数联系起来的一个基本物理量 | |
| B. | 1摩尔H2SO4的质量为98g/mol | |
| C. | 国际上规定,0.012 kg 碳原子所含有的碳原子数目为 1 mol | |
| D. | 1摩尔氢气分子可以表示为1mol H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾--Al2(SO4)3•12H2O | B. | 漂白粉--NaClO | ||
| C. | 苏打粉--NaHCO3 | D. | 水煤气--CO、H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3 mL | B. | 7.5 mL | C. | 15 mL | D. | 22.5 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com