
| A. | 等质量的CH4、C2H4、C2H2分别在氧气中完全燃烧,消耗氧气的量依次减少 | |
| B. | 淀粉、纤维素和油脂都属于天然高分子化合物 | |
| C. | 苯的结构比较稳定,发生取代反应相对比较容易,发生苯环结构被破坏的加成反应困难得多,而氧化反应不能发生 | |
| D. | 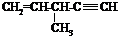 催化加氢可生成3-甲基己烷 催化加氢可生成3-甲基己烷 |
分析 A.质量相同时,分子中H元素的质量分数越大,完全燃烧时消耗O2越多;
B.油脂的相对分子质量在10000以下;
C.苯能燃烧,属于氧化反应;
D.加氢后,主链含5个C.
解答 解:A.CH4、C2H4、C2H2的H%大小为:CH4>C2H4>C2H2,质量相同时,分子中H元素的质量分数越大,完全燃烧时消耗O2越多,故完全燃烧时消耗O2的量最多的是CH4,消耗氧气的量依次减少,故A正确;
B.淀粉、纤维素都属于天然高分子化合物,而油脂不是,故B错误;
C.苯的结构比较稳定,发生取代反应相对比较容易,发生苯环结构被破坏的加成反应困难得多,能发生氧化反应,如苯燃烧,故C错误;
D.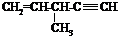 催化加氢可生成3-甲基戊烷,故D错误;
催化加氢可生成3-甲基戊烷,故D错误;
故选A.
点评 本题考查有机物的结构与性质,为高频考点,把握性质与结构为解答的关键,侧重分析与应用能力的考查,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
 .试写出由上述元素组成的分子中含有4个原子核且为18电子结构的物质的化学式H2O2.
.试写出由上述元素组成的分子中含有4个原子核且为18电子结构的物质的化学式H2O2.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有A、D、E、G、M、L六种前四周期的元素.A是宇宙中最丰富的元素.D原子核外有1个未成对电子,D+比E原子少一个电子层,E原子得一个电子填入3p轨道后,3p轨道呈全充满状态.G原子的2p轨道有2个未成对电子,M的最高化合价和最低化合价的代数和为4,与G的原子序数相差8.L位于周期表第12纵行且是六种元素中原子序数最大的.R是由M、L形成的化合物,其晶胞结构如图所示.请回答下列问题:
有A、D、E、G、M、L六种前四周期的元素.A是宇宙中最丰富的元素.D原子核外有1个未成对电子,D+比E原子少一个电子层,E原子得一个电子填入3p轨道后,3p轨道呈全充满状态.G原子的2p轨道有2个未成对电子,M的最高化合价和最低化合价的代数和为4,与G的原子序数相差8.L位于周期表第12纵行且是六种元素中原子序数最大的.R是由M、L形成的化合物,其晶胞结构如图所示.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 非金属单质A和金属单质M可发生如图所示的转化关系,L的焰色是黄色,往L的溶液中加入稀盐酸和BaCl2溶液会生成白色沉淀.
非金属单质A和金属单质M可发生如图所示的转化关系,L的焰色是黄色,往L的溶液中加入稀盐酸和BaCl2溶液会生成白色沉淀.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2的电子式: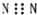 | |
| B. | 甲烷分子的比例模型是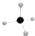 | |
| C. | 硝基和二氧化氮两种粒子所含电子数相等 | |
| D. | 中子数为10的氧原子:${\;}_{8}^{10}$O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
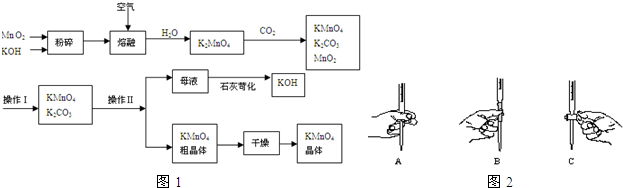
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H4 | B. | C2H2 | C. | C3H4 | D. | C4H6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu (CuO),加盐酸,过滤 | B. | Na2CO3 (NaHCO3)固体,加热 | ||
| C. | KNO3 (K2SO4),加BaCl2溶液,过滤 | D. | MgO (Al2O3),加烧碱溶液,过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有6.02×1023个氦原子的氦气在标准状况下的体积约为11.2 L | |
| B. | 在常温常压下,11.2 L Cl2含有的分子数为0.5×6.02×1023 | |
| C. | 25℃,1.01×105Pa,64 g SO2中含有的原子数为3×6.02×1023 | |
| D. | 标准状况下,11.2 L H2O含有的分子数为0.5×6.02×1023 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com