
【题目】氨主要用于生产化肥和硝酸。“十三五”期间,预计我国合成氨产量将保持稳中略增。
(1)目前工业上用氮气和氢气合成氨的生产条件为_________。
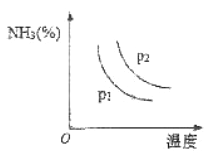
(2)下图是不同温度和不同压强下,反应达到平衡后,混合物中NH3含量(体积%)的变化情况,己知初始时n(N2):n(H2)=1:3。由图可知,合成氨的反应是______反应(选填“吸热”、“放热”);判断pl、p2压强的大小关系,pl_______p2 (选填“>”、 “<”或“=”)。
(3)草木灰主要含有碳酸钾,解释草木灰不宜与铵态氮肥混合使用的原因_____________ 。
 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源: 题型:
【题目】中学化学中下列各物质间不能实现![]() (“→”表示一步完成)转化的是:
(“→”表示一步完成)转化的是:
A | B | C | D | |
a | CH3CH2OH | CH2===CH2 | 硬脂酸 | HCOOCH3 |
b | CH3CHO | CH3CH2Br | 硬脂酸甘油酯 | CH3OH |
c | CH3COOH | CH3CH2OH | 硬脂酸钠 | HCOOH |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】S2Cl2是工业上常用的硫化剂,已知S2C12中硫元素显+1价,它不稳定,在水中易发生岐化反应,易溶于有机溶剂。实验室常用CS2与纯净的氯气制备S2C12。反应涉及到的几种物质的熔沸点如下:
物质 | CS2 | Cl2 | CCl4 | S2C12 |
沸点/℃ | 47 | -34.6℃ | 77 | 137 |
熔点/℃ | -109 | -100.98℃ | -23 | -77 |
实验室利用下列装置制备S2C12 (部分夹持仪器己略去):
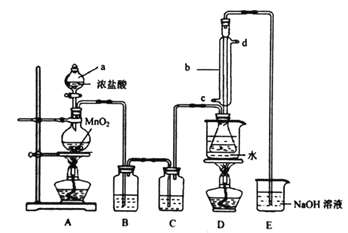
回答下列问题:
(1)装置中b玻璃仪器的名称为_______;写出制备S2C12的化学方程式_______。
(2)整套装置装配完毕后,首先进行的操作是________,再添加试剂。
(3)实验中盐酸试剂通常采用36.5%的浓盐酸,不用稀盐酸的理由是________。
装置A中反应的离子方程式是___________。
(4) D中采用热水浴加热的原因是__________,反应结束后从锥形瓶内混合物中分离出产品的方法是_______________。
(5)实验过程中,若缺少C装置,则发现产品浑浊不清,出现该现象的原因化学方程式表示为__________。
(6)该实始装置设计存在缺陷,你的改进建议及改进目的是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的叙述正确的是
A. 聚乙烯塑料中含有大量碳碳双键,容易老化
B. 苯、油脂均不能使酸性KMnO4溶液褪色
C. 甲苯苯环上的一个氢原子被一C3H6Cl取代,形成的同分异构体有9种
D. CH2=CHCH2OH能发生加成反应、取代反应、氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z和W代表原子序数依次增大的四种短周期主族元素.它们满足以下条件:①在元素周期表中,Z与Y、W均相邻;②X、Y、W分别位于不同周期;③Y、Z、W三种元素的原子最外层电子数之和为17。下列说法错误的是
A. X、Y、Z既能形成离子化合物.又能形成共价化合物
B. Y和Z元素的原子半径大小顺序为Y>Z
C. X与Y、Z之问形成的核外电子总数为10的微粒只有YX3和X2Z
D. Z、W元索的最简单氢化物的沸点和稳定性均为H2Z>H2W
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一固定容积的密闭容器中,进行如下反应:C(s)+H2O(g) ![]() CO(g)+H2(g)
CO(g)+H2(g)
(1)若容器体积为2L,反应l0s氢气质量增加0.4g,则该时间内一氧化碳的反应速率为_______mol/(L.s)。若增加炭的量,则正反应速率_______。(选填“增大”、“减小”、不变)若增大压强,化学平衡向____移动。(选填“正向”、“逆向”或“不”)
(2)该反应达到平衡状态的标志是______。(选填编号)
A.压强不变 B.v正(H2)=V正(H2O) C.c(CO)不变 D.c(H2O)=c(CO)
(3)若升高温度,平衡向正向移动,则正反应是_______反应。(选填“吸热”或“放热”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某矿样含有大量的CuS及少量其它不溶于酸的杂质。实验室中以该矿样为原料制备CuCl2·2H2O晶体,流程如下:

(1)在实验室中,欲用37%(密度为1.19 g·mL-1)的盐酸配制500 mL 6mol·L-1的盐酸,需要的仪器除量筒、烧杯、玻璃棒外,还有__________________、__________________。
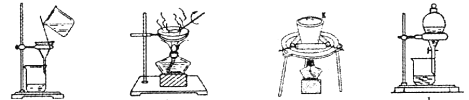
(2)①若在实验室中完成系列操作a。则下列实验操作中,不需要的是___________(填下列各项中序号)。
②CuCl2溶液中存在如下平衡: ![]() 欲用实验证明滤液A(绿色)中存在上述平衡,除滤液A外,下列试剂中,还需要的是 _________(填下列各项中序号)。
欲用实验证明滤液A(绿色)中存在上述平衡,除滤液A外,下列试剂中,还需要的是 _________(填下列各项中序号)。
a.FeCl3固体 b.CuCl2固体 c.蒸馏水
(3)某化学小组欲在实验室中研究CuS焙烧的反应过程,查阅资料得知在空气条件下焙烧 CuS时,固体质量变化曲线及SO2生成曲线如下图所示。
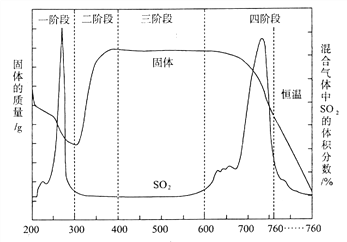
① CuS矿样在焙烧过程中,有![]() 生成,转化顺序为:
生成,转化顺序为:
![]()
第①步转化主要在200~300℃范围内进行,该步转化的化学方程式为________________________。
② 300~400℃范围内,固体质量明显增加的原因是__________________________,上图所示过程中,CuSO4固体能稳定存在的阶段是_________________(填下列各项中序号)。
a.一阶段 b.二阶段 c.三阶段 d.四阶段
③ 该化学小组设计如下装置模拟CuS矿样在氧气中焙烧第四阶段的过程,并验证所得气体为SO2和O2的混合物。
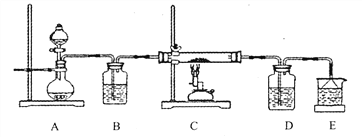
a.装置组装完成后,应立即进行的一项操作是___________________________。
b.当D装置中产生白色沉淀时,便能说明第四阶段所得气体为SO2和O2的混合物,你认为装置D中原来盛有的溶液为______________溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在不同温度下按照相同物质的量投料发生反应:CO(g)+2H2(g)![]() CH3OH(g) △H<0,测得CO的平衡转化率与压强的关系如图所示,有关说法正确的是
CH3OH(g) △H<0,测得CO的平衡转化率与压强的关系如图所示,有关说法正确的是

A. 反应温度:T1>T2
B. 正反应速率:υ正(y)= υ正(w)
C. 混合气体密度:ρ(x)>ρ(w)
D. 混合气体平均摩尔质量:M(y)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2O2是一种常见的氧化剂,某同学设计了一系列实验来探究氮氧化物能否被Na2O2完全吸收。装置如下(加热装置省略):
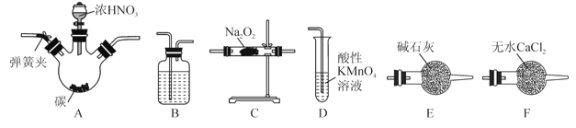
已知:
①2NO+Na2O2=2NaNO2;
②酸性条件下,NO或NO2都能与KMnO4溶液反应生成NO3-。
I.探究NO能否被Na2O2=完全吸收
(1)所选择的装置按从左至右顺序排列依次是______________(填字母)。
(2)检査完该装置的气密性,装入药品后,实验开始前通入一段时间N2,其目的是________________。
(3)烧瓶A中反应的化学方程式为______________;D装置的作用是____________;若NO能被Na2O2完全吸收,D装置中的现象为__________________。
(4)亚硝酸钠(NaNO2)被称为工业盐,在漂白、电镀等方面应用广泛。若利利用该装置将4.68g Na2O2完全转化为NaNO2,理论上至少需要木炭的质量为_________g,为提高NaNO2的产量,在不改变实验装置的条件下,可在B中加入_________物质。
Ⅱ.探究NO2能否被NaNO2完全吸收
(5)将A中碳换为铜片,探究NO2能否被Na2O2完全吸收。若NO2与Na2O2反应只生成一种盐,则C装罝内发生反应的化学方程式为____________________。
(6)若NO2未被完全吸收,则D装置中反应的离子方程式为________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com