
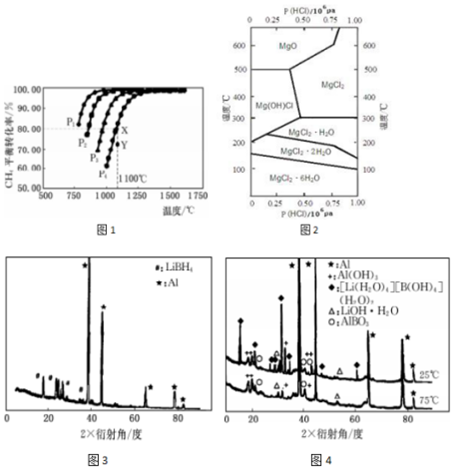
·ÖĪö £Ø1£©¢ŁÓÉĶ¼æÉÖŖ£¬ĪĀ¶ČŅ»¶ØŹ±£¬¼×ĶéµÄ×Ŗ»ÆĀŹ¦Į£ØP1£©£¾¦Į£ØP2£©£¾¦Į£ØP3£©£¾¦Į£ØP4£©£¬¾Ż“Ė½įŗĻ·½³ĢŹ½ÅŠ¶ĻŃ¹Ēæ¶ŌĘ½ŗāŅĘ¶ÆµÄÓ°Ļģ½ųŠŠ½ā“š£»Ń¹ĒæŅ»¶ØŹ±£¬ĪĀ¶ČŌ½øß¼×ĶéµÄ×Ŗ»ÆĀŹŌ½“ó£¬ÉżøßĪĀ¶ČĘ½ŗāĻņÕż·“Ó¦½ųŠŠ£¬¾Ż“ĖÅŠ¶Ļ£»
¢ŚÓÉĶ¼æÉÖŖ£¬Ń¹ĒæĪŖP4”¢1100”ęµÄĢõ¼žĻĀ£¬µ½“ļĘ½ŗāXµćŹ±¼×ĶéµÄ×Ŗ»ÆĀŹĪŖ80%£¬Yµć¼×ĶéµÄ×Ŗ»ÆĀŹŠ”ÓŚ80%£¬·“Ó¦ĻņÕż·“Ó¦½ųŠŠ£¬¾Ż“ĖÅŠ¶Ļ£»
¢ŪÓÉĶ¼æÉÖŖ£¬Ń¹ĒæĪŖP4”¢1100”ęµÄĢõ¼žĻĀ£¬µ½“ļĘ½ŗāXµćŹ±¼×ĶéµÄ×Ŗ»ÆĀŹĪŖ80%£¬¾Ż“Ė¼ĘĖć¼×ĶéµÄÅØ¶Č±ä»ÆĮ棬ĄūÓĆČż¶ĪŹ½¼ĘĖćĘ½ŗāŹ±ø÷×é·ÖµÄĘ½ŗāÅØ¶Č£¬“śČėĘ½ŗā³£Źż±ķ“ļŹ½¼ĘĖćøĆĪĀ¶ČĻĀµÄĘ½ŗā³£Źż£»
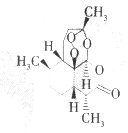
£Ø2£©a”¢ÓÉĶ¼æÉÖŖP£ØHCl£©g=0.25MPa£¬ĪĀ¶Č“Ó300”ęÉżøßµ½500”ꏱMgCl2•6H2O¾§ĢåÓÉMg£ØOH£©Cl×Ŗ±ä³ÉMgO£»
b”¢ÓÉĶ¼æÉÖŖĪĀ¶ČµĶÓŚ100”ę£¬MgCl2•6H2O²»»į·¢Éś·Ö½ā£»
c”¢¼ÓČČMgCl2•6H2O¾§Ģ壬P£ØHCl£©g½ĻŠ”£¬Ć¾Ąė×ÓĖ®½āÉś³ÉĒāŃõ»ÆĆ¾£¬µĆ²»µ½ĀČ»ÆĆ¾£¬ČōŅŖµĆµ½ĪŽĖ®ĀČ»ÆĆ¾£¬ŌņÓ¦ĶØČėHCl£¬¶ųŌö“óP£ØHCl£©g£¬ŅÖÖĘĆ¾Ąė×ÓµÄĖ®½ā£»
d”¢ÓÉĶ¼æÉÖŖŌŚHClĘųĢåŃ¹ĒæĪŖ0.25”Į106PaŹ±£¬ĪĀ¶ČÓÉŹŅĪĀÉżøßÖĮ300”ę£¬·¢ÉśµÄ·“Ó¦ĪŖMgCl2•6H2OØTMg£ØOH£©Cl+HCl+5H2O£»
£Ø3£©ČēĶ¼ĪŽLiBH4£¬ĖµĆ÷ÓėĖ®ĶźČ«·“Ó¦£»øł¾ŻĶ¼Ļó¶Ō±Č·ÖĪö25”ęŗĶ75”ꏱ²śĪļÖŠ²»ĻąĶ¬µÄĪļÖŹ£®
½ā“š ½ā£ŗ£Ø1£©¢ŁÓÉĶ¼æÉÖŖ£¬ĪĀ¶ČŅ»¶ØŹ±£¬¼×ĶéµÄ×Ŗ»ÆĀŹ¦Į£ØP1£©£¾¦Į£ØP2£©£¾¦Į£ØP3£©£¾¦Į£ØP4£©£¬øĆ·“Ó¦Õż·“Ó¦ŹĒĘųĢåĢå»żŌö“óµÄ·“Ó¦£¬Ōö“óŃ¹ĒæĘ½ŗāĻņÄę·“Ó¦½ųŠŠ£¬¼×ĶéµÄ×Ŗ»ÆĀŹ½µµĶ£¬¹ŹŃ¹ĒæP4£¾P3£¾P2£¾P1£»Ń¹ĒæŅ»¶ØŹ±£¬ĪĀ¶ČŌ½øß¼×ĶéµÄ×Ŗ»ÆĀŹŌ½“ó£¬ÉżøßĪĀ¶ČĘ½ŗāĻņÕż·“Ó¦½ųŠŠ£¬¹ŹÕż·“Ó¦ĪŖĪüČČ·“Ó¦£¬¼“”÷H£¾0£¬
¹Ź“š°øĪŖ£ŗP1£»£¾£»
¢ŚÓÉĶ¼æÉÖŖ£¬Ń¹ĒæĪŖP4”¢1100”ęµÄĢõ¼žĻĀ£¬µ½“ļĘ½ŗāXµćŹ±¼×ĶéµÄ×Ŗ»ÆĀŹĪŖ80%£¬Yµć¼×ĶéµÄ×Ŗ»ÆĀŹŠ”ÓŚ80%£¬·“Ó¦ĻņÕż·“Ó¦½ųŠŠ£¬¹ŹŌŚYµć£ŗv£ØÕż£©£¾v£ØÄę£©£¬
¹Ź“š°øĪŖ£ŗ£¾£»
¢ŪÓÉĶ¼æÉÖŖ£¬Ń¹ĒæĪŖP4”¢1100”ęµÄĢõ¼žĻĀ£¬“ļµ½Ę½ŗāXµćŹ±¼×ĶéµÄ×Ŗ»ÆĀŹĪŖ80%£¬¼×ĶéµÄÅØ¶Č±ä»ÆĮæĪŖ0.1mol/L”Į80%=0.08mol/L£¬Ōņ£ŗ
CH4£Øg£©+CO2£Øg£©=2CO£Øg£©+2H2£Øg£©£¬
æŖŹ¼£Ømol/L£©£ŗ0.1 0.1 0 0
±ä»Æ£Ømol/L£©£ŗ0.08 0.08 0.16 0.16
Ę½ŗā£Ømol/L£©£ŗ0.02 0.02 0.16 0.16
¹ŹøĆĪĀ¶ČĻĀĘ½ŗā³£Źżk=$\frac{0.1{6}^{2}”Į0.1{6}^{2}}{0.02”Į0.02}$=1.64£¬¹Ź“š°øĪŖ£ŗ1.64£»
£Ø2£©a”¢ÓÉĶ¼æÉÖŖP£ØHCl£©g=0.25MPa£¬ĪĀ¶Č“Ó300”ęÉżøßµ½500”ꏱMgCl2•6H2O¾§ĢåÓÉMg£ØOH£©Cl×Ŗ±ä³ÉMgO£¬¹Źa“ķĪó£»
b”¢ÓÉĶ¼æÉÖŖĪĀ¶ČµĶÓŚ100”ę£¬MgCl2•6H2O²»»į·¢Éś·Ö½ā£¬¹ŹbÕżČ·£»
c”¢¼ÓČČMgCl2•6H2O¾§Ģ壬P£ØHCl£©g½ĻŠ”£¬Ć¾Ąė×ÓĖ®½āÉś³ÉĒāŃõ»ÆĆ¾£¬µĆ²»µ½ĀČ»ÆĆ¾£¬ČōŅŖµĆµ½ĪŽĖ®ĀČ»ÆĆ¾£¬ŌņÓ¦ĶØČėHCl£¬¶ųŌö“óP£ØHCl£©g£¬ŅÖÖĘĆ¾Ąė×ÓµÄĖ®½ā£¬¹Źc“ķĪó£»
d”¢ÓÉĶ¼æÉÖŖŌŚHClĘųĢåŃ¹ĒæĪŖ0.25”Į106PaŹ±£¬ĪĀ¶ČÓÉŹŅĪĀÉżøßÖĮ300”ę£¬·¢ÉśµÄ·“Ó¦ĪŖMgCl2•6H2OØTMg£ØOH£©Cl+HCl+5H2O£¬¹ŹdÕżČ·£»
¹ŹŃ”£ŗbd£»
£Ø3£©ČēĶ¼ĪŽLiBH4£¬ĖµĆ÷ÓėĖ®ĶźČ«·“Ó¦£»ÓÉĶ¼Ļó25”ęŗĶ75”ꏱ²śĪļ¶Ō±ČÖŠ²»ĻąĶ¬µÄĪļÖŹĪŖ[Li£ØH2O£©4][B£ØOH£©4]£ØH2O£©2£¬
¹Ź“š°øĪŖ£ŗLiBH4£»[Li£ØH2O£©4][B£ØOH£©4]£ØH2O£©2£®
µćĘĄ ±¾Ģāæ¼²é»ÆŃ§Ę½ŗāĶ¼Ļó”¢Ó°Ļģ»ÆŃ§Ę½ŗāµÄŅņĖŲ”¢»ÆŃ§Ę½ŗā³£ŹżŅŌ¼°Ķ¼±ķŠÅĻ¢µÄĢįČ”µČ£¬ĢāÄæÄѶČÖŠµČ£¬×¢ŅāĄūÓĆ”°¶ØŅ»Ņ鶞”±ŌŌņ·ÖĪö½ā“š£¬ÅąŃųѧɜøł¾ŻĶ¼ĻóĢįČ”ŠÅĻ¢µÄÄÜĮ¦£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
 ÖŠ¹śÖŠŅ½ŃŠ¾æŌŗÖÕÉķŃŠ¾æŌ±¼ęŹ×ĻÆŃŠ¾æŌ±ĶĄßĻßĻÓŚ1971ÄźŹ×ĻČ“Ó»Ę»ØŻļÖŠ·¢ĻÖæ¹Å±ÓŠŠ§ĢįČ”Īļ£¬1972Äź·ÖĄė³öŠĀŠĶ½į¹¹µÄæ¹Å±ÓŠŠ§³É·ÖĒąŻļĖŲ£¬Õü¾ČĮĖŹżĒ§ĶņČĖµÄÉśĆü£®ĒąŻļĖŲµÄ·Ö×Ó½į¹¹ČēĶ¼£®ĻĀĮŠĖµĒÓ“ķĪóµÄŹĒ£Ø””””£©
ÖŠ¹śÖŠŅ½ŃŠ¾æŌŗÖÕÉķŃŠ¾æŌ±¼ęŹ×ĻÆŃŠ¾æŌ±ĶĄßĻßĻÓŚ1971ÄźŹ×ĻČ“Ó»Ę»ØŻļÖŠ·¢ĻÖæ¹Å±ÓŠŠ§ĢįČ”Īļ£¬1972Äź·ÖĄė³öŠĀŠĶ½į¹¹µÄæ¹Å±ÓŠŠ§³É·ÖĒąŻļĖŲ£¬Õü¾ČĮĖŹżĒ§ĶņČĖµÄÉśĆü£®ĒąŻļĖŲµÄ·Ö×Ó½į¹¹ČēĶ¼£®ĻĀĮŠĖµĒÓ“ķĪóµÄŹĒ£Ø””””£©| A£® | ĒąŻļĖŲµÄ·Ö×ÓŹ½ĪŖC15H22O5 | |
| B£® | ĒąŻļĖŲŹĒ·¼Ļć×å»ÆŗĻĪļ | |
| C£® | ĒąŻļĖŲ·Ö×ÓÖŠŗ¬ÓŠ¹żŃõĮ“”¢õ„»łŗĶĆŃ¼ü | |
| D£® | ĒąŻļĖŲ²»ÄÜ·¢Éś¼Ó³É·“Ó¦ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ÅØĮņĖįÓėÅØŃĪĖįŌŚæÕĘųÖŠ³ØæŚ·ÅÖĆŹ±ÅØ¶Č¾ł¼õŠ” | |
| B£® | ½šŹōµ¼µēÓėµē½āÖŹČÜŅŗµ¼µē | |
| C£® | ŌŚ¾»Ė®¹ż³ĢÖŠ·Ö±šŹ¹ÓĆĆ÷·ÆŗĶĘÆ°×·Ū | |
| D£® | ¹¤ŅµÉĻÖĘČ”½šŹōĢśŗĶ½šŹōĶ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Ō×Ó°ė¾¶µÄ“óŠ”Ė³Šņ£ŗr£ØZ£©£¾r£ØY£©£¾r£ØX£© | |
| B£® | ¼ņµ„Ēā»ÆĪļµÄĪČ¶ØŠŌ£ŗW£¾Z | |
| C£® | ŌŖĖŲXµÄµ„ÖŹÖ»“ęŌŚĮ½ÖÖĶ¬ĖŲŅģŠĪĢå | |
| D£® | X”¢Y”¢W×īøß¼ŪŃõ»ÆĪļ¶ŌÓ¦µÄĖ®»ÆĪļĮ½Į½Ö®¼äÄÜ·¢Éś·“Ó¦ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | NH4ClµÄµē×ÓŹ½£ŗ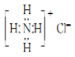 | |
| B£® | ĖÄĀČ»ÆĢ¼·Ö×ÓĒņ¹÷Ä£ŠĶ£ŗ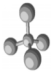 | |
| C£® | ±ūĻ©Č©µÄ½į¹¹¼ņŹ½£ŗCH3CH2COH | |
| D£® | Ģ¼ĖįĒāøłĄė×ÓµÄĖ®½ā·½³ĢŹ½£ŗHCO3-+H2O?CO32-+H3O |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
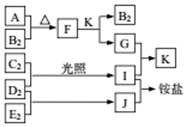 ČēĶ¼ŹĒ²æ·Ö¶ĢÖÜĘŚŌŖĖŲµÄµ„ÖŹ¼°Ęä»ÆŗĻĪļ£Ø»ņČÜŅŗ£©µÄ×Ŗ»Æ¹ŲĻµ£¬ŅŃÖŖµ„ÖŹB2”¢C2”¢D2”¢E2ŌŚ³£ĪĀ³£Ń¹ĻĀ²æŹĒĘųĢ壬»ÆŗĻĪļGµÄŃęÉ«·“Ó¦ĪŖ»ĘÉ«£»»ÆŗĻĪļI”¢J”¢KĶس£×“æöĻĀ³ŹĘųĢ¬£®ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø””””£©
ČēĶ¼ŹĒ²æ·Ö¶ĢÖÜĘŚŌŖĖŲµÄµ„ÖŹ¼°Ęä»ÆŗĻĪļ£Ø»ņČÜŅŗ£©µÄ×Ŗ»Æ¹ŲĻµ£¬ŅŃÖŖµ„ÖŹB2”¢C2”¢D2”¢E2ŌŚ³£ĪĀ³£Ń¹ĻĀ²æŹĒĘųĢ壬»ÆŗĻĪļGµÄŃęÉ«·“Ó¦ĪŖ»ĘÉ«£»»ÆŗĻĪļI”¢J”¢KĶس£×“æöĻĀ³ŹĘųĢ¬£®ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø””””£©| A£® | BĒā»ÆĪļµÄ·ŠµćøßÓŚĘäĶ¬Ö÷×åĘäĖüŌŖĖŲĒā»ÆĪļµÄ·Šµć | |
| B£® | Ō×Ó°ė¾¶“󊔣ŗA£¾C£¾B£¾E£¾D | |
| C£® | FÖŠ¼Čŗ¬ÓŠĄė×Ó¼üÓÖŗ¬ÓŠ¼«ŠŌ¹²¼Ū¼ü | |
| D£® | GÖŠµÄŅõĄė×ÓÄÜŅÖÖĘĖ®µÄµēĄė |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
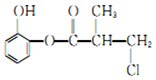
| A£® | ÓŠ»śĪļAÓėÅØĮņĖį»ģŗĻ¼ÓČČ£¬æÉŅŌ·¢ÉśĻūČ„·“Ó¦ | |
| B£® | 1 molA Óė×ćĮæµÄH2·¢Éś¼Ó³É·“Ó¦£¬×ī¶ąæÉŅŌĻūŗÄ4mol H2 | |
| C£® | 1 molA Óė×ćĮæµÄNaOH ČÜŅŗ³ä·Ö·“Ó¦£¬×ī¶ąæÉŅŌĻūŗÄ4 mol NaOH | |
| D£® | ÓŠ»śĪļA µÄĶ¬·ÖŅģ¹¹ĢåÖŠÄÜŌŚĻ”ĮņĖį“ęŌŚĻĀĖ®½āÉś³É¶ž±½·ÓµÄÓŠ6 ÖÖ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ĪŽÉ«³ĪĒåĶøĆ÷ČÜŅŗÖŠ£ŗH+”¢Cu2+”¢SO42-”¢Cl- | |
| B£® | 0.1 mol•L-1AlCl3ČÜŅŗÖŠ£ŗH+”¢Na+”¢Cl-”¢SO42- | |
| C£® | pH=13µÄČÜŅŗÖŠ£ŗNH4+”¢K+”¢NO3-”¢HCO3- | |
| D£® | c£Ø£ØOH-£©£¼$\sqrt{{K}_{w}}$µÄČÜŅŗ£ŗCa2+”¢Fe2+”¢NO3-”¢ClO- |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ICl+H2O=HCl+HIO | B£® | 2K+2H2O=2KOH+H2”ü | ||
| C£® | 2F2+2H2O=4HF+O2 | D£® | 2Na2O2+2H2O=4NaOH+O2 |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com