
分析 A、B、C、D四种元素都是短周期元素,A元素的离子具有黄色的焰色反应,则A为Na元素;5.8g B的氢氧化物恰好能与100mL 2mol•L-1盐酸完全反应,则n(H+)=n(OH-),设B的化合价为x,摩尔质量为y,则$\frac{5.8}{17x+y}$×x=0.2,显然x=2,y=24符合,B原子核中质子数和中子数相等,则B的质子数为12,即B为Mg元素;H2在C单质中燃烧产生苍白色火焰,则C为Cl元素;D元素原子的电子层结构中,最外层电子数是次外层电子数的3倍,原子只能有2个电子层,最外层电子数为6,即D为O元素.
解答 解:A、B、C、D四种元素都是短周期元素,A元素的离子具有黄色的焰色反应,则A为Na元素;5.8g B的氢氧化物恰好能与100mL 2mol•L-1盐酸完全反应,则n(H+)=n(OH-),设B的化合价为x,摩尔质量为y,则$\frac{5.8}{17x+y}$×x=0.2,显然x=2,y=24符合,B原子核中质子数和中子数相等,则B的质子数为12,即B为Mg元素;H2在C单质中燃烧产生苍白色火焰,则C为Cl元素;D元素原子的电子层结构中,最外层电子数是次外层电子数的3倍,原子只能有2个电子层,最外层电子数为6,即D为O元素.
(1)元素C为Cl元素,最高价氧化物的化学式为:Cl2O7,故答案为:Cl2O7;
(2)元素A为钠,元素B为镁,故答案为:钠;镁;
(3)A与D形成稳定的化合物的化学式为Na2O2,故答案为:Na2O2;
(4)C元素的单质有毒,A的最高价氧化物对应的水化物为NaOH,用氢氧化钠溶液吸收氯气的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O,故答案为:Cl2+2OH-=Cl-+ClO-+H2O.
点评 本题考查位置结构性质的关系及应用,利用讨论法确定B元素是解答本题的关键,熟悉掌握元素及其单质、化合物的性质,难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
 ,是非极性分子(填“极性”或“非极性”),一种由B、C组成的化合物与AC2互为等电子体,其化学式为N2O
,是非极性分子(填“极性”或“非极性”),一种由B、C组成的化合物与AC2互为等电子体,其化学式为N2O查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入硝酸酸化了的硝酸钡溶液,有白色沉淀生成 | |
| B. | 加入盐酸酸化了的氯化钡溶液,有白色沉淀生成 | |
| C. | 先加硝酸酸化,无沉淀,再加硝酸钡溶液,有白色沉淀生成 | |
| D. | 先加盐酸酸化,无现象,再加氯化钡溶液,有白色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙烯分子中三个碳原子在同一条直线上 | |
| B. | 丙烯可使酸性高锰酸钾溶液褪色 | |
| C. | 丙烯可使溴水褪色 | |
| D. | 丙烯能发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 |  |  | 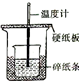 |
| A.测量锌与稀硫酸反应的速率 | B.构造铜锌原电池 | C.进行酸碱中和滴定实验 | D.测定中和热 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com