
| A. | 在100℃、101 kPa条件下,液态水的气化热为40.69 kJ•mol-1,则H2O(g)?H2O(l) 的△H=40.69 kJ•mol-1 | |||||||||||
| B. | Li、Be、B三种元素的第一电离能(I1)差别不大,而I2差别很大,则三种原子中最难失去第二个电子的是Be | |||||||||||
| C. | 已知:
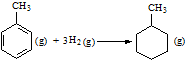 的△H为-384 kJ•mol-1 的△H为-384 kJ•mol-1 | |||||||||||
| D. | 固体NH5的所有原子的最外层均满足2个或8个电子的稳定结构,它与水反应的化学方程式为NH5+H2O═NH3•H2O+H2↑ |
分析 A、从不同状态的物质之间的转化判断,一般来说,气体转化为液体、液体转化为固体,反之吸热;
B、电子能量越低,越不容易失去,电离能越大;
C、苯环中不存在典型的碳碳双键和碳碳单键,不能用表中数据进行计算;
D、它与H2O反应,H-具有还原性,H2O具有氧化性,可生成氨气和氢气.
解答 解:A、气体转化为液体是放热过程,则正确的表达为:H2O(g)?H2O(l)△H=-40.69kJ•mol-1,故A错误;
B、Li原子第二电离能为失去1s能级电子,而Be、B原子第二电离能为失去2s能级电子,2s能级电子能量较高,Li原子第二电离能最高,故三种原子中最难失去第二个电子的是Li,故B错误;
C、因为苯环中的碳碳键是介于单双键之间的一种独特的键,不存在典型的碳碳双键和碳碳单键,不能用以上表中进行计算,故C错误;
D、它与H2O反应,H-具有还原性,H2O具有氧化性,可生成氨气和氢气,反应的方程式为NH5+H2O═NH3•H2O+H2↑,故D正确;
故选D.
点评 本题考查反应热、电离能、氧化还原反应等问题,本题易错点为C项,注意苯的结构特点.


科目:高中化学 来源: 题型:选择题
| X | Y | Z | M | |
| A | N2 | NO | NO2 | O2 |
| B | Cl2 | FeCl3 | FeCl2 | Fe |
| C | Al2O3 | NaAlO2 | Al(OH)3 | NaOH |
| D | S | SO2 | SO3 | O2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
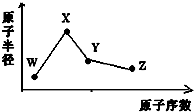 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期主族元素中最大.
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期主族元素中最大.| A. | ②④⑥ | B. | ③④⑤⑥ | C. | ②③④⑤ | D. | ①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 向Ba(OH)2溶液中滴加稀硫酸:Ba2++2OH-+2H++SO42-═BaS04↓+2H2O | |
| B. | 酸性介质中KMnO4氧化 H2O2:2MnO4-+5H2O2+6H+═2Mn2++5O2↑+8H2O | |
| C. | 等物质的量的MgCl2、Ba(OH)2 和 HC1 溶液混合:Mg2++2OH-═Mg(OH)2↓ | |
| D. | 铁铜原电池(稀硫酸做电解质)放电时的负极反应:Fe-3e-═Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | SO2有漂白性 | SO2可使溴水褪色 |
| B | Cl2有漂白性 | Cl2能使品红溶液褪色 |
| C | 浓硫酸有脱水性 | 浓硫酸可用于干燥H2和CO |
| D | Fe3+有强氧化性 | FeCl3溶液可用于回收废旧电路板中的铜 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
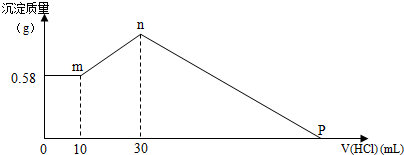
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com