
| A. | 稀HNO3 | B. | CO | C. | CH3CH2CH2OH | D. | 稀H2SO4 |
分析 先铜丝灼烧成黑色,生成CuO:2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO,插入溶液中能使铜丝变红,而且质量仍为mg,说明CuO被还原生成Cu,以此解答该题.
解答 解:A.铜丝灼烧成黑色,立即放入稀硝酸中,CuO、Cu与稀硝酸反应,生成铜盐,质量减少,故A错误;
B.CO和CuO发生氧化还原反应生成Cu,质量不变,故B正确;
C.铜丝灼烧成黑色,立即放入C2H5OH中,CuO与C2H5OH反应:CuO+C2H5OH$\stackrel{△}{→}$CH3CHO+Cu+H2O,反应后铜丝质量保持不变,故C正确;
D.铜丝灼烧成黑色,立即放入硫酸中,CuO与硫酸反应,生成铜盐,铜丝质量减少,故D错误.
故选BC.
点评 本题综合考查了铜及其化合物的性质,为高频考点,侧重于元素化合物知识的综合理解和运用的考查,难度不大,注意乙醇与氧化铜反应的性质.


 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:选择题
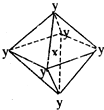 在某晶体中,与某一种微粒x距离最近且等距离的另一种微粒y所围成的空间构型为正八面体型(如图).该晶体可能为( )
在某晶体中,与某一种微粒x距离最近且等距离的另一种微粒y所围成的空间构型为正八面体型(如图).该晶体可能为( )| A. | NaCl | B. | CsCl | C. | CO2 | D. | SiO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .该物质遇水剧烈反应,产生有刺激性气味的混合气体X和Y,同时还有固体单质产生,X是一种能使品红溶液褪色的气体,Y在标准状态下的密度为1.63g/L,该混合气体相对于H2的密度为21,写出上述过程对应的化学方程式2S2Cl2+2H2O=SO2↑+4HCl↑+3S↓.某研究性小组同学开动脑筋,为确定干燥的X 和Y混合气体中Y的存在,设计方案如下:把干燥的X和Y与干燥的NH3混合,出现白烟,则证明有Y气体.你认为此方案正确 (填正确,不正确),理由是SO2与干燥的NH3不反应,而HCl和干燥的NH3反应生成白烟.
.该物质遇水剧烈反应,产生有刺激性气味的混合气体X和Y,同时还有固体单质产生,X是一种能使品红溶液褪色的气体,Y在标准状态下的密度为1.63g/L,该混合气体相对于H2的密度为21,写出上述过程对应的化学方程式2S2Cl2+2H2O=SO2↑+4HCl↑+3S↓.某研究性小组同学开动脑筋,为确定干燥的X 和Y混合气体中Y的存在,设计方案如下:把干燥的X和Y与干燥的NH3混合,出现白烟,则证明有Y气体.你认为此方案正确 (填正确,不正确),理由是SO2与干燥的NH3不反应,而HCl和干燥的NH3反应生成白烟.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 现有丙炔和氢气的混合气体5L,其中氢气在混合气体中的体积分数为x,在催化剂作用下,经充分反应后得到的气体的体积为V L(所有体积均在同温同压下测定).
现有丙炔和氢气的混合气体5L,其中氢气在混合气体中的体积分数为x,在催化剂作用下,经充分反应后得到的气体的体积为V L(所有体积均在同温同压下测定).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{1}{2}$ N2H4(g)+$\frac{1}{2}$O2(g)=$\frac{1}{2}$N2(g)+H2O(l)△H=+267kJ•mol-1 | |
| B. | N2H4(g)+O2(g)=N2(g)+2H2O(l)△H=-133.5kJ•mol-1 | |
| C. | N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=+534kJ•mol-1 | |
| D. | N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 负极的电极反应式为 CH3OH+8OH--6e-=CO32-+6H2O | |
| B. | 正极的电极反应式为4OH-+4e-=2H2O+O2↑ | |
| C. | 标准状况下,通入5.6L O2并完全反应后,有0.50 mol电子转移 | |
| D. | 放电一段时间后,通入O2的电极附近溶液的pH减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应速率是用于衡量化学反应进行快慢的物理量 | |
| B. | 决定化学反应速率的主要因素是反应物本身的性质 | |
| C. | 可逆反应达到化学平衡状态时,反应停止,正、逆反应速率都为零 | |
| D. | 增大反应物浓度或升高反应温度都能加快化学反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com