
| A. | 稀硫酸 | B. | 氯水 | C. | 硝酸锌 | D. | 双氧水 |
分析 A.再加硫酸,不与Fe2+发生反应;
B.再加氯水,将亚铁离子氧化为铁离子;
C.加硝酸锌,在酸性条件下具有硝酸的氧化性;
D.再加双氧水,将亚铁离子氧化为铁离子.
解答 解:铁屑溶于过量盐酸后,生成亚铁离子,
A.再加硫酸,不发生反应,不会有三价铁生成,故A选;
B.再加氯水,将亚铁离子氧化为铁离子,故B不选;
C.加硝酸锌,在酸性条件下具有硝酸的氧化性,可氧化亚铁离子生成铁离子,故C不选;
D.再加双氧水,将亚铁离子氧化为铁离子,故D不选;
故选A.
点评 本题以铁的化学性质考查氧化还原反应,把握物质的性质及氧化性为解答的关键,选项C为解答的难点,注意硝酸盐在酸性条件下的氧化性,题目难度不大.


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:选择题
| A. | NaCl MgCl2 Na2O | B. | H2O Na2O ? CO2 | ||
| C. | CaCl2 ? NaOH H2SO4 | D. | NH4Cl H2O CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 可用溴水区分化合物Ⅱ和化合物Ⅲ | |
| B. | 化合物Ⅰ中所有原子可能在同一平面 | |
| C. | 化合物Ⅰ、Ⅱ、Ⅲ均能与NaHCO3溶液发生反应 | |
| D. | 1 mol化合物Ⅰ最多能与3 mol H2发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 1:91 |
| pH | 8.2 | 7.2 | 6.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
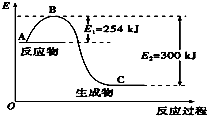 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.| 化学键 | H-H | N≡N |
| 键能/kJ•mol-1 | 435 | 943 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子核外电子排布呈现周期性变化 | |
| B. | 原子的电子层数增多 | |
| C. | 元素的相对原子质量逐渐增大,量变引起质变 | |
| D. | 原子半径呈周期性变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硫酸能与灼热的木炭反应,生成二氧化碳和二氧化硫 | |
| B. | 浓硫酸具有吸水性,在实验室中常用作干燥剂 | |
| C. | 常温下,可以用铁质或铝质容器储存浓硫酸或浓硝酸 | |
| D. | 浓硫酸与铜反应产生的气体对环境无影响 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com