
| A. | 8mL | B. | 8.5mL | C. | l0mL | D. | 10.5mL |
分析 剩余的气体可能为氧气,有可能为NO,①当剩余的气体为氧气时,二氧化氮和NO完全反应,可以根据方程式4NO2+O2+2H2O═4HNO3、4NO+3O2+2H2O═4HNO3计算出通入氧气的总体积;
②当剩余的气体为NO时,可以看作二氧化氮完全反应,NO反应消耗了8mL,还剩余2mL,然后根据反应方程式计算出消耗的氧气的体积.
解答 解:①当剩下的气体为O2时,10mLNO2和10mL NO说明完全反应生成硝酸,则:
4NO2+O2+2H2O═4HNO3,4NO+3O2+2H2O═4HNO3,
4 1 4 3
10mL 2.5mL 10mL 7.5mL
所以通入的氧气体积为:2.5mL+7.5mL+2mL=12mL;
②当剩余的气体为NO时,可以认为10mL NO2完全反应生成硝酸,10mLNO中剩余2mL,有8mL转化成硝酸,则:
4NO2+O2+2H2O═4HNO3,4NO+3O2+2H2O═4HNO3,
4 1 4 3
10mL 2.5mL 8mL 6mL
所以通入氧气的体积为:2.5mL+6mL=8.5mL,
故选B.
点评 本题考查了有关混合物反应的化学计算,题目难度中等,明确反应后剩余气体组成为解答关键,注意掌握NO、二氧化氮与氧气、水转化成硝酸的反应原理,要求学生掌握讨论法在化学计算中的应用.


 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:选择题
| A. | Fe2O3$\stackrel{HCI(ap)}{→}$FeCl3(aq)$\stackrel{△}{→}$无水FeCl3 | |
| B. | 饱和NaCl(aq) $\stackrel{NH_{3},CO_{2}}{→}$ NaHCO3$\stackrel{△}{→}$Na2CO3 | |
| C. | Al2O3$\stackrel{NaOH(ap)}{→}$NaAlO2(aq) $\stackrel{过量HCI}{→}$Al(OH)3 | |
| D. | 海水$\stackrel{Ca(OH)_{2}}{→}$Mg(OH)2$\stackrel{HCI(ap)}{→}$MgCl2(aq)$\stackrel{电解}{→}$Mg |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2(HCl)用NaOH溶液 | B. | Na2CO3(NaHCO3)用HCl溶液 | ||
| C. | NaCl溶液(I2)用CCl4 | D. | FeCl2(FeCl3)通入Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

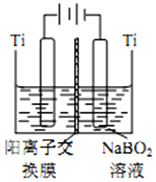
| 温度(℃) 溶解度(g) | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+的数目为NA | B. | OH-的物质的量为1mol | ||
| C. | Na+的物质的量浓度为1mol/L | D. | NaOH的质量为40g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度会使正反应速率升高逆反应速率减慢 | |
| B. | 在高温和催化剂作用下,H2可以100%地转化为NH3 | |
| C. | 当NH3的浓度是N2的二倍时,反应达到平衡状态 | |
| D. | 使用催化剂可以加快反应速率,提高生产效率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| Z | |
| X | Y |
| A. | Z元素的最高正化合价,一定等于其主族序数 | |
| B. | 它们的原子半径由大到小的顺序一定是Y>X>Z | |
| C. | 若它们的原子最外层电子数之和为11,则它们均为非金属元素 | |
| D. | 若它们均为非金属元素,则X与氧元素组成的物质一定是酸性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2mol/L | B. | 0.5mol/L | C. | 0.3mol/L | D. | 0.4mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 32g O2和O3的混合物中含有的分子数目为2NA | |
| B. | 标准状况下,22.4L二氯甲烷含有NA个分子 | |
| C. | 25℃,1L pH=1的硫酸溶液中,H+的数目为0.2NA | |
| D. | 10g 46%的乙醇溶液中含有的氧原子数目为0.4NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com