
 计算硫酸的浓度,结合浓硫酸溶液的浓度越大密度越大,进行判断.
计算硫酸的浓度,结合浓硫酸溶液的浓度越大密度越大,进行判断. 公式变形计算硫酸的质量分数,结合硫酸溶液的浓度越大密度越大,进行判断.
公式变形计算硫酸的质量分数,结合硫酸溶液的浓度越大密度越大,进行判断.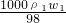 ,c2=
,c2=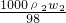 ,所以
,所以 =
=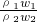 =
=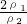 ,浓硫酸的浓度越大密度越大,则ρ1>ρ2,故c1>2c2,故A正确;
,浓硫酸的浓度越大密度越大,则ρ1>ρ2,故c1>2c2,故A正确;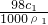 ,w2=
,w2=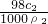 ,
,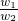 =
=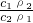 =
=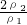 ,浓硫酸的浓度越大密度越大,则ρ1>ρ2,故w1<2w2,故C错误;
,浓硫酸的浓度越大密度越大,则ρ1>ρ2,故w1<2w2,故C错误;

 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案科目:高中化学 来源:不详 题型:单选题
| A.若w1=2w2,则c1>2c2,V=100mL |
| B.若w1=2w2,则c1<2c2,V=100mL |
| C.若c1=2c2,则w1>2w2,V>100mL |
| D.若c1=2c2,则w1=2w2,V=100mL |
查看答案和解析>>
科目:高中化学 来源:2010-2011学年湖北省十堰一中高三(上)月考化学试卷(10月份)(解析版) 题型:选择题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com