
| 1.147 |
| 160g/mol |
| 0.903g |
| 18g/mol |
| 0.05017mol |
| 0.007169mol |
| 7-5 |
| 5 |


科目:高中化学 来源: 题型:
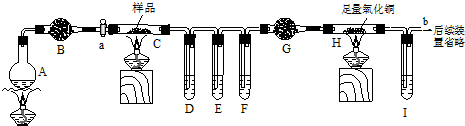
查看答案和解析>>
科目:高中化学 来源: 题型:
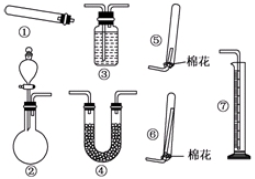
| 试剂组合 | ①Ca(OH)2 NH4Cl | ②Ca(OH)2(NH4)2SO4 | ③CaO NH4Cl | ④CaO(NH4)2SO4 |
| NH3体积( mL) | 1344 | 1364 | 1792 | 1753 |
| 实际产量 |
| 理论产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
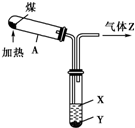
| A、图中操作发生了化学变化 |
| B、液体X的pH>7,液体Y是一种黑色黏稠状液体 |
| C、气体Z易燃,可还原CuO,但不能使溴水褪色 |
| D、试管A中得到的固体可用于工业炼铁、制粗硅等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
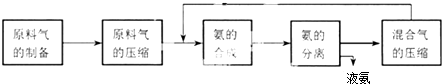
| A、混合气进行循环利用遵循绿色化学思想 |
| B、对原料气进行压缩可以增大原料气的转化率 |
| C、合成氨反应须在低温下进行 |
| D、使用催化剂可以提高反应的速率,但是不能使平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、合成氨生产过程中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率 |
| B、铁钉镀锌,将锌与电源负极相连,电镀过程需要控制电流强度、溶液pH等条件 |
| C、海轮外壳绑上锌板是采用牺牲阳极的阴极保护法,从而减缓钢铁腐蚀速率 |
| D、电解精炼铜时,阳极溶解铜的总质量和阴极析出铜的总质量相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、3.2 g |
| B、(2m-3.2)g |
| C、(m-1.6)g |
| D、(2m-1.6)g |
查看答案和解析>>
科目:高中化学 来源: 题型:
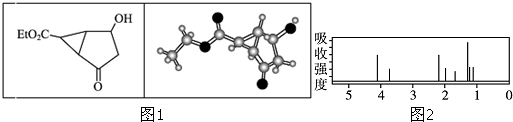
| A、该有机物不同化学环境的氢原子有6种 |
| B、该有机物属于芳香化合物 |
| C、键线式中的Et代表的基团为-CH3 |
| D、该有机物在一定条件下能够发生消去反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com