
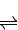 CH3OH(g)+H2O(g),如图1表示该反应过程中能量的变化:
CH3OH(g)+H2O(g),如图1表示该反应过程中能量的变化: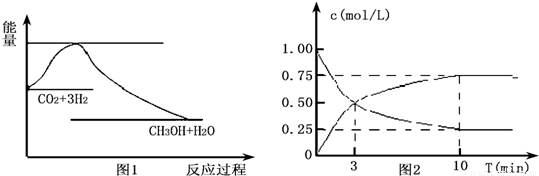
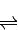 CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图2所示.
CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图2所示. CH3OH(g)+H2O(g),反应是熵减少的反应△S<0;反应物能量高于生成物的能量,判断反应是放热反应,△H<0;
CH3OH(g)+H2O(g),反应是熵减少的反应△S<0;反应物能量高于生成物的能量,判断反应是放热反应,△H<0; CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图2所示.二氧化碳是反应物随反应进行浓度减小,甲醇是生成物,随反应进行浓度增大;10nim内达到平衡,生成甲醇浓度为0.75mol/L,二氧化碳浓度变化了0.75mol/L;①依据化学平衡三段式列式计算判断;②依据化学平衡常数的概念书写平衡常数计算式;③依据化学反应的影响因素和条件逐项分析判断;
CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图2所示.二氧化碳是反应物随反应进行浓度减小,甲醇是生成物,随反应进行浓度增大;10nim内达到平衡,生成甲醇浓度为0.75mol/L,二氧化碳浓度变化了0.75mol/L;①依据化学平衡三段式列式计算判断;②依据化学平衡常数的概念书写平衡常数计算式;③依据化学反应的影响因素和条件逐项分析判断; O2(g)=CO2(g)+2H2O(l)△H=-726.6 kJ?mol-1;
O2(g)=CO2(g)+2H2O(l)△H=-726.6 kJ?mol-1; CH3OH(g)+H2O(g),反应是熵减少的反应△S<0;反应物能量高于生成物的能量,判断反应是放热反应,△H<0,
CH3OH(g)+H2O(g),反应是熵减少的反应△S<0;反应物能量高于生成物的能量,判断反应是放热反应,△H<0, CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图2所示.二氧化碳是反应物随反应进行浓度减小,甲醇是生成物,随反应进行浓度增大;10nim内达到平衡,生成甲醇浓度为0.75mol/L,二氧化碳浓度变化了0.75mol/L;则
CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图2所示.二氧化碳是反应物随反应进行浓度减小,甲醇是生成物,随反应进行浓度增大;10nim内达到平衡,生成甲醇浓度为0.75mol/L,二氧化碳浓度变化了0.75mol/L;则 CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g) =0.075mol?L-1?min-1 ;H2的转化率w(H2)=
=0.075mol?L-1?min-1 ;H2的转化率w(H2)= ×100%=56.25%,
×100%=56.25%, ,故答案为:
,故答案为: ;
; O2(g)=CO2(g)+2H2O(l)△H=-726.6 kJ?mol-1;
O2(g)=CO2(g)+2H2O(l)△H=-726.6 kJ?mol-1; O2(g)=CO2(g)+2H2O(l)△H=-726.6 kJ?mol-1;
O2(g)=CO2(g)+2H2O(l)△H=-726.6 kJ?mol-1;

 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
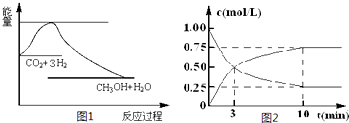
| c(CH3OH)?c(H2O) |
| c(CO2)?c3(H2) |
| c(CH3OH)?c(H2O) |
| c(CO2)?c3(H2) |
| 3 |
| 2 |
| 3 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
| 催化剂 |
| 加热 |
| 催化剂 |
| 加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| C(CH3OH)?C(H2O) |
| C(CO2)?C3(H2) |
| C(CH3OH)?C(H2O) |
| C(CO2)?C3(H2) |
| 3 |
| 2 |
| 3 |
| 2 |
查看答案和解析>>
科目:高中化学 来源:2014届陕西省高二下学期期末考试化学试卷(解析版) 题型:填空题
实现 “节能减排” 和“低碳经济”的一项重要课题就是如何将CO2转化为可利用的资源。目前工业上有一种方法是用CO2来生产燃料甲醇。一定条件下发生反应:
 CO2(g)+3H2(g)
CO2(g)+3H2(g) CH3OH(g)+H2O(g),下图1表示该反应过程中能量变化:
CH3OH(g)+H2O(g),下图1表示该反应过程中能量变化:
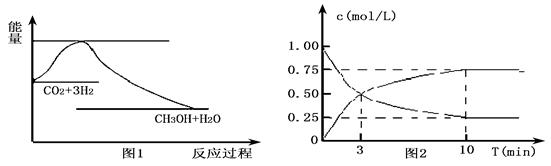
(1)关于该反应的下列说法中,正确的是____________(填字母)。
A.△H>0,△S>0 B.△H>0,△S<0
C.△H<0,△S<0 D.△H<0,△S>0
(2)为探究反应原理,现进行如下实验,在体积为l L的密闭容器中,充入l mol
CO2和4mol H2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如上图2所示。
CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如上图2所示。
①从反应开始到平衡,CO2的平均反应速率v(CO2)= ;
H2的转化率w(H2) = 。
②该反应的平衡常数表达式K= 。
③下列措施中能使化学平衡向正反应方向移动的是 (填字母)。
A.升高温度
B.将CH3OH(g)及时液化抽出
C.选择高效催化剂
(3)25℃,1.01×105Pa时,16g液态甲醇完全燃烧,当恢复到原状态时,放出363.3kJ的热量,写出该反应的热化学方程式:_____________。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年山西大学附中高三2月月考(理综)化学部分 题型:选择题
工业上以黄铁矿为原料生产硫酸。
(1)写出燃烧黄铁矿的化学方程式 。
(2)接触室中发生反应的化学方程式是 。
(3)判断下列说法正确的是(选填序号字母) 。
a.为使黄铁矿充分燃烧,需将其粉碎
b.过量空气能提高SO2的转化率
c.使用催化剂能提高SO2的反应速率和转化率
d.沸腾炉排出的矿渣可供炼铁
(4)吸收塔中用浓硫酸吸收三氧化硫而不用水的原因是是 。
(5)吸收塔排出的尾气可以用两种方法处理:
方法①:先用氨水吸收,再用浓硫酸处理。用浓硫酸处理的主要目的是 ;
方法②:先用含一定水的亚硫酸钠吸收后再加热处理,也可达到与方法①相同的目的。为了实现节能减排,其所需能量可以由 提供。与方法①相比,方法②的优点是 。
(6)SO2 既可作为生产硫酸的原料循环再利用,也可用于工业制溴过程中吸收潮湿空气中的Br2。SO2 吸收Br2的离子方程式是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com