
研究离子晶体,常考查1个离子为中心时其周围不同距离的离子对它的吸引和排斥的静电作用力。设NaCl晶体中Na+与 离它最近的Cl-之间的距离为d,以其中1个Na+为中心,其他离子可看做围绕此Na+分层排布,则:
(1)第二层离子是 离子,有 个,离中心离子的距离为 。
(2)纳米材料的表面原子占总原子数的比例极大,这是它具有许多特殊性质的根本原因。假设某氯化钠纳米颗粒的大小和形状恰好和NaCl晶胞的相同,求这种纳米颗粒的表面原子占总原子数的百分比。
(3)假设某氯化钠颗粒也是立方体,但其边长为NaCl晶胞边长的10倍,试估算表面原子占总原子数的百分比。
(1)Na+ 12 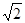 d (2)
d (2)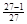 ×100%=96%(3)
×100%=96%(3)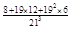 ×100%=26%
×100%=26%
【解析】
试题分析:(1)解答本题的关键是要弄清NaCl晶体的排列规则,如图所示,●为Cl-,×为Na+,Na+处于立方体的中心和12条棱的中心,Cl-处于立方体的顶点和面心。离中心Na+最近的是6个处于面心的Cl—(第一层),其次近的是12个Na+(第二层)。
(2)将Na+和Cl-均看成小球,它们的间距为d,则在1个NaCl晶胞中共有小球3×3×3=27个,其中只有1个处于体心,另外26个都在表面上,所以表面原子占原子总数的百分比是很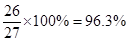 。
。
(3)假设将晶胞的立方体边长扩大为原来的10倍,从其表面图可以看出
晶体的边长为20d,可放2×10+1=21个小球
所以共有213=9261个小球
其中,顶点8个
棱心:21-2=19个
面心:192=361个
所以,表面球为8+19×12+192×6=2402个
由此得到表面原子占总原子数的百分比为
考点:考查晶胞结构的判断、计算
点评:本题难度较大,对学生的能力要求较高。该题既能巩固学生的基础知识,又能培养学生的逻辑思维能力,提高分析问题、解决问题的能力,易于激发学生的求知欲。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
(1)第二层离子是____________离子,有____________个,离中心离子的距离为___________。
(2)纳米材料的表面原子占总原子数的比例极大,这是它具有许多特殊性质的根本原因。假设某氯化钠纳米颗粒的大小和形状恰好和NaCl晶胞的相同,求这种纳米颗粒的表面原子占总原子数的百分比。
(3)假设某氯化钠颗粒也是立方体,但其边长为NaCl晶胞边长的10倍,试估算表面原子占总原子数的百分比。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com