
下列与实验相关的叙述正确的是()
A. 将FeCl3稀溶液加热蒸发浓缩制备FeCl3的浓溶液
B. 做氢气还原氧化铜的实验是,应先通氢气后加热氧化铜
C. 稀释浓硫酸时,应将蒸馏水沿烧杯内壁缓慢地注入浓硫酸中并不断搅拌
D. 配制1 mol•L﹣1350mLNaCl溶液可以选择一个100mL的容量瓶和一个250 mL的容量瓶
考点: 化学实验方案的评价.
专题: 实验评价题.
分析: A.铁离子易发生水解;
B.氢气和空气混合加热易发生爆炸;
C.稀释浓硫酸时,应该将浓硫酸缓缓加入水中并不断 搅拌,顺序不能颠倒;
搅拌,顺序不能颠倒;
D.容量瓶为定容仪器,配制350mL氯化钠溶液需要选用500mL容量瓶,不能用一个100mL的容量瓶和一个250 mL的容量瓶配制,否则容易产生较大误差.
解答: 解:A.铁离子易发生水解生成氢氧化铁,故A错误;
B.氢气和空气混合加热易发生爆炸,实验开始先通入氢气,故B正确;
C.浓硫酸密度大于水,稀释浓硫酸时应该将浓硫酸缓缓加入水中,顺序不能颠倒,故C 错误;
错误;
D.配制1mol•L﹣1 350mL NaCl溶液,不能选择一个100mL的容量瓶和一个250 mL的容量瓶,应该选用500mL容量瓶配制,故D错误.
故选B.
点评: 本题考查化学实验方案的评价,为高频考点,涉及配制一定物质的量浓度的溶液的方法、盐类水解等等,侧重实验基本操作和实验原理的考查,注意装置的作用及实验的操作性、评价性分析,题目难度不大.


科目:高中化学 来源: 题型:
到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源.
(1)在25℃、101kPa下,16g的甲醇(CH3OH)完全燃烧生成CO2和液态水时放出352kJ的热量,则表示甲醇燃烧热的热化学方程式为 .
(2)化学反应中放出的热能(焓变,△H)与反应物和生成物的键能(E)有关.
已知:H2 (g)+Cl2 (g)=2HCl (g)△H=﹣185kJ/molE(H﹣H)=436kJ/mol E(Cl﹣Cl)=243kJ/mol则E(H﹣Cl)=
(3)纳米级Cu2O由于具有优良的催化性能而受到关注.已知:
2Cu(s)+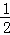 O2(g)═Cu2O(s)△H=﹣169kJ•mol﹣1,
O2(g)═Cu2O(s)△H=﹣169kJ•mol﹣1,
C(s)+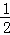 O2(g)═CO(g)△H=﹣110.5kJ•mol﹣1,
O2(g)═CO(g)△H=﹣110.5kJ•mol﹣1,
2Cu(s)+O2(g)═2CuO(s)△H=﹣314kJ•mol﹣1
则工业上用炭粉在高温条件下还原CuO制取Cu2O和CO的热化学方程式为 .
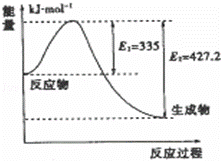
(4)①如图是N2和H2反应生成2mol NH3过程中能量变化示意图,请计算每生成1mol NH3放出热量为: .
②若起始时向容器内放入1mol N2和3mol H2,达平衡后N2的转化率为20%,则反应放出的热量为Q1 kJ,则Q1的数值为 ;若在同体积的容器中充入2mol N2和6mol H2,达平衡后放出的热量为Q2 kJ,则Q2 2Q1(填“>”、“<”或“=”)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是()
A. 要实现Fe2+→Fe3+的转化必须加入氧化剂
B. 失电子难的原子获得电子的能力一定强
C. 得到电子越多的氧化剂,其氧化性就越强
D. 阳离子只有氧化性,阴离子只有还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
某实验小组用工业上废弃固体(主要成分Cu2S和Fe2O3)混合物制取粗铜和Fe2(SO4)3晶体,设计的操作流程如图:

(1)除酒精灯和铁架台或三脚架外,①中所需的容器和夹持仪器分别为 ,①和⑥中都用到的仪器为 ;
(2)试剂x的化学式为H2O2;x与溶液B反应的离子方程式为 ;
(3)某同学取少量的溶液B向其中加入过量的某种强氧化剂,再滴加KSCN溶液,发现溶液变红色,放置一段时间后,溶液褪色,该同学猜测溶液褪色的原因是溶液中的SCN﹣ 被过量的氧化剂氧化所致,现给出以下试剂:1.0mol•L﹣1硫酸、1.0mol•L﹣1 NaOH溶液、0.1mol•L﹣1 Fe2(SO4)3溶液、20%KSCN溶液、蒸馏水.请你设计合理实验验证乙同学的猜测是否合理.简要说明实验步骤和现象 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列溶液中Cl﹣的物质的量浓度与100ml 1mol•L﹣1AlCl3溶液中Cl﹣相等的是()
A. 150ml 1 mol•L﹣1氯化钠溶液
B. 75ml 2 mol•L﹣1氯化镁溶液
C. 50ml 3mol•L﹣1氯化钾溶液
D. 200ml 1.5 mol•L﹣1氯化铁溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
已知FeS2中铁元素的化合价为+2价,关于反应:4CuSO4+5FeS2+12H2O═7Cu2S+5FeSO4+12H2SO4的下列说法正确的是()
A. 该反应的氧化剂只有CuSO4
B. SO42﹣既不是氧化产物也不是还原产物
C. 1 mol CuSO4还原了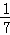 mol的S
mol的S
D. 被还原的S和被氧化的S的质量比为7:3
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示是用于气体制备、干燥(或除杂质)、性质验证、尾气处理的部分仪 器装置(加热及夹持固定装置均已略去,各装置可重复使用也可不用).请根据下列要求回答问题.
器装置(加热及夹持固定装置均已略去,各装置可重复使用也可不用).请根据下列要求回答问题.
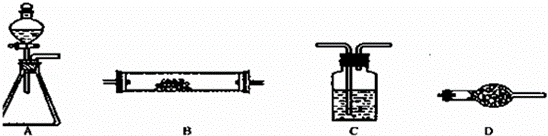
(1)若用A﹣C﹣D﹣B组合进行氢气还原氧化铜实验.分液漏斗中的试剂是盐酸,C中试剂是水,其作用是 ;A中反应开始一段时间后,再加热B.加热B之前的实验操作是 .
(2)为验证氯气不能使干燥的红布条褪色,置红布条于B中,按A﹣C﹣B﹣D连接成实验装置体系.A锥形瓶中试剂选用高锰酸钾晶体,则分液漏斗中的液体是 (填名称);C中试剂是浓硫酸(填名称).已知高锰酸钾反应生成+2价的锰离子,写出此法制备氯气的离子方程式 .
(3)为了进行氨的催化氧化实验,若锥形瓶中盛装足量的Na2O2粉末,分液漏斗中盛装浓氨水,慢慢打开分液漏斗的活塞,产生的气体通过红热的铂粉,各仪器装置按气流方向从左到右连接顺序是(填字母) ;装置B中发生反应的化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
为确定某溶液的离子组成,分别进行如下实验:
①测定溶液的pH,溶液显强碱性.
②取少量溶液加入稀盐酸至溶液呈酸性,产生无刺激性、能使澄清石灰水变浑浊的气体.
③在上述溶液中再滴加Ba(NO3)2溶液,产生白色沉淀.
④取上层清液继续滴加Ba(NO3)2溶液至无沉淀时,再滴加AgNO3溶液,产生白色沉淀.
根据实验以下推测正确的是()
A. 一定有SO32﹣离子
B. 一定有CO32﹣离子
C. 一定有Cl﹣离子存在
D. 不能确定HCO3﹣离子是否存在
查看答案和解析>>
科目:高中化学 来源: 题型:
如图中X、Y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色无臭气体放出,如图中符合这一情况的是()
A极板 B极板 X电极 Z溶液
A 锌 石墨 负极 CuSO4
B 石墨 石墨 负极 NaOH
C 银 铁 正极 AgNO3
D 铜 石墨 负极 CuCl2
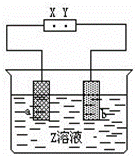
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com