
【题目】在强酸性溶液中,能大量共存的离子组是( )
A. K+、Cu2+、OH﹣、SO42- B. Fe3+、NH4+、NO3-、Cl﹣
C. K+、Na+、Cl﹣、CO32- D. K+、![]() 、MnO4-、SO42-
、MnO4-、SO42-
科目:高中化学 来源: 题型:
【题目】完成下列化学方程式:
(1)碳酸氢钠受热分解的方程式________________________________________
(2)NO2溶于水发生的反应____________________________________________
(3)NH3与O2的反应_________________________________________________
(4)HNO3见光或受热的分解反应_______________________________________
(5)Cu与稀HNO3的反应_____________________________________________
(6)Cu与浓H2SO4的反应_____________________________________________
(7)C与浓H2SO4的反应 _____________________________________________
(8)Mg与CO2的反应 ________________________________________________
(9)Al与Fe2O3高温条件下的铝热反应_____________________________________
(10)Al与NaOH溶液的反应___________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W四种物质有如下相互转化关系(其中X、W为单质,Y、Z为化合物,未列出反应条件)
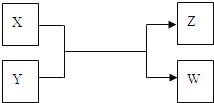
Ⅰ.若Z是生活中常用的调味品,W遇淀粉溶液变蓝,则:
(1)常温下,X的颜色是____________。
(2)工业上Z有多种用途,用化学方程式表示Z的一种用途_________________________。
(3)生活中所用的Z加入了碘酸钾,过量X与Y溶液反应时可以得到这种碘酸盐,此反应的离子方程式是______________________________________。
Ⅱ.若X是工业上用量最大的金属单质,Z是一种具有磁性的黑色晶体,则:
(1)X与Y反应的化学方程式是__________________________________。
(2)将3.48g Z加入50mL 4mol/L的稀HNO3中充分反应,产生112mL的NO(标准状况),向反应后的溶液中滴加NaOH溶液能产生沉淀.当沉淀量最多,至少需要加入2mol/L的NaOH溶液_____mL (精确到0.1)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,下列判断中正确的是

A. 电路中电子的流动方向为: adCuSO4(ag)cb
B. d电极反应式为: Cu2++2e-=Cu,反应后CuSO4溶液的浓度降低
C. C电极质量减少量等于d电极质量增加量
D. 该原电池原理为 Zn+ Cu2+= Zn2++Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一绝热(不与外界发生热交换)的恒容容器中,发生反应:2A(g)+B(s) ![]() C(g)+D(g),下列描述中不能表明反应已达到平衡状态的是( )
C(g)+D(g),下列描述中不能表明反应已达到平衡状态的是( )
A. 混合气体的密度不变 B. 单位时间内生成n molD,同时生成n molC
C. 混合气体的平均相对分子质量不变 D. C(g)的物质的量浓度不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在碱性溶液中可发生如下反应: 2R(OH)3+3ClO-+4OH-=2RO42-+3Cl-+5H2O。则RO42-中R的化合价是
A. +3B. +4C. +5D. +6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子中,能在溶液中大量共存的是( )
A.Na+、Mg2+、Br-、SO42-B.K+、Ca2+、HCO3-、OH-
C.Fe2+、H+、SO42-、NO3-D.Na+、Cu2+、Cl-、S2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的Mg-Al合金投入100mL一定物质的量浓度的某HCl溶液中,充分反应。向反应后的溶液中逐滴加入一定物质的量浓度的NaOH溶液,生成沉淀的质量与所加NaOH溶液的体积关系如下图。回答下列问题:
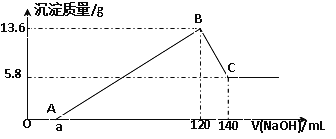
(1)写出OA段和BC段反应的离子方程式:OA:___________ ; BC:___________;
(2)原Mg-Al合金的质量是_____________。
(3)原NaOH溶液的物质的量浓度是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物AX3和单质X在一定条件下反应可生成化合物AX3。反应AX3(g)+X2(g)=AX5(g)在容积为10L的密闭容器中进行。起始时AX3和X2均为0.2mol.反应在不同条件下进行,反应体系总压强随时间的变化如图所示。回答下列问题:

(1)下列式计算实验a从反应开始至达到平衡时的反应速率v(AX5)=_________
(2)图中3组实验从反应开始至达到平衡时的反应速率v(AX5)由大到小的次序为____(填实验序号);与实验a相比,b改变的实验条件及判断依据是:_________
(3)用p0表示开始时总压强,p表示平衡时总压强,α表示AX5的平衡转化率,则a的表达式为_______;实验a和c的平衡转化率:αa为______,αc为_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com