
【题目】下列卤化氢分子中键的极性最大的是( )
A. HFB. HClC. HBrD. HI
 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案科目:高中化学 来源: 题型:
【题目】从薄荷油中得到一种烃A(C10H16),与A相关反应如下:
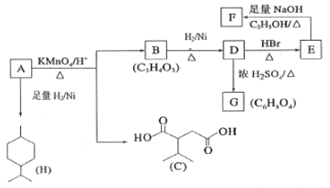
已知: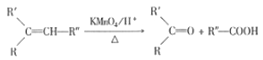
(1)B所含官能团的名称为___。
(2)含两个-COOCH3基团的C的同分异构体共有___种(不考虑手性异构),其中核磁共振氢谱显示2个吸收峰的异构体结构简式为________。
(3)D→E的反应类型为_________。
(4)G为含六元环的化合物,写出其结构简式________。
(5)F在一定条件下发生聚合反应可得到一种高吸水性树脂,该树脂名称为____。
(6)写出E→F的化学反应方程式:________________。
(7)参照上述合成路线,设计由苯为原料(无机试剂任选)合成己二酸的合成路线________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于氢键,下列说法正确的是( )
A. 氢键是一种化学键
B. 冰中存在氢键、液态氟化氢中不存在氢键
C. H2O是一种非常稳定的化合物,这是由于氢键所致
D. 氨气极易溶于水,重要的原因之一是由于氨分子与水分子之间能形成氢键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaHS溶液中加入一定量的CuSO4溶液,发生的反应的离子方程式可能为( )
A.S2﹣+Cu2+→CuS↓
B.2HS﹣+Cu2+→CuS↓+2H++S2﹣
C.HS﹣+Cu2+→CuS↓+H+
D.2HS﹣+Cu2+→CuS↓+H2S↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了有香味的酯。在实验室也可以用如下图所示的装置制取乙酸乙酯,请回答下列问题。

(1)乙醇分子中官能团的名称是_______。
乙酸中的官能团的结构简式 ________。
(2)试管a中加入几块碎瓷片的目的是____________。
(3)试管a中发生反应的化学方程式为_______________________,反应类型是__________。
(4)反应开始前,试管b中盛放的溶液是____________。
(5)可用____________的方法把制得的乙酸乙酯分离出来。
(6)浓硫酸的作用 _______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】连二亚硫酸钠(Na2S2O4)又称保险粉,在纺织行业中常用于还原染色剂。
己知连二亚硫酸钠具有下列性质:在空气中极易被氧化,不溶于甲醇,易溶于水,遇水迅速分解为亚硫酸氢钠和硫代硫酸钠,在碱性介质中较稳定。回答下列问题:
(1)二氧化硫的制备
原料:亚硫酸钠固体和70%的浓硫酸
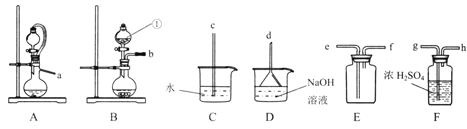
(1)仪器①的名称是_______________。
(2)实验室制取干燥二氧化硫的装置连接顺序为______(选择上图中部分仪器,按气流方向用小写字毋排序),选择该气体发生装置的原因是________________。
(3)设计实验证明二氧化硫具有还原性_______(实验中可选用的试剂有:品红溶液、氢硫酸、溴水,滴有酚酞的氢氧化钠溶液)
(二)保险粉的制备

I.在G装置中加入甲酸钠浓溶液、氢氧化钠,甲醇(溶剂)的混合液;
II:打开K1、K2,一段时间后,向装置中通入二氧化硫;
III.加热一段时间,装置中有黄色晶体析出,并产生大量气体;
IV.过滤、洗涤、干燥,收集产品。
(1)写出步骤II中制备保险粉的化学方程式____________。
(2)简述步骤IV保险粉的洗涤方法:在无氧环境中,_________________。
(3) 步骤IV干燥保险粉的最佳方法为________(选填序号)。
A.空气中蒸发干燥 B.氯化氢气流中蒸发干燥 C.真空干燥
(三)保险粉的含量测定
铁氰化物滴定法原理是:4K3[Fe(CN)6]+2Na2S2O4+8KOH=3K4[Fe(CN)6]+4Na2SO3+Na4[Fe(CN)6]+4H2O
I.另取一套G装置,加入一定体积的氢氧化钠溶液,通入N2;
II.称取样品mg加入装置G中搅拌,溶解,再加入2-3滴亚甲基蓝指示剂;
III.用浓度为cmol·L-1的K3[Fe(CN)6]滴定,至滴定终点时,记录消耗的体积为VmL。
保险粉质量分数表达式为__________(用含c、m、V的代数式表示)。
(2)若在滴定前未向锥形瓶中通氮气,则会导致测定的保险粉含量______(填“偏高”、“偏低”或“无影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃和101kpa时,乙烷、乙炔和丙烯组成的混合烃32mL与过量氧气混合并完全燃烧,除去水蒸气,恢复到原来的温度和压强,气体的总体积缩小了72mL,原混合烃中乙炔的体积分数为
A.12.5% B.25% C.50% D.75%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】保险粉(Na2S2O4)有极强的还原性,遇热水或潮湿空气会分解发热,但在碱性环境下较稳定。回答下列问题:
(1)二氧化硫的制备

①二氧化硫的发生装置可以选择上图中的_____________(填大写字母),反应的化学方程式为______________________。
②欲收集一瓶干燥的二氧化硫,选择上图中的装置,其接口的连接顺序为发生装置→__________________→→______→______→ ____________。(按气流方向,用小写字母表示)
(2)保险粉的制备
在35-45℃下,将SO2气体通入锌粉一水悬浮液中(如图),使之发生反应生成ZnS2O4;待反应完全后,移走恒温水浴装置并冷却至室温,向三颈烧瓶中加人18%的NaOH溶液,使之发生反应生成Na2S2O4和Zn(OH)2;经一系列操作后得到无水Na2S2O4样品。

①实验开始时,应先关闭止水夹K3、打开K1和K2,通入一段时间SO2,其原因是__________。
②通过观察_________________,调节止水夹K1来控制SO2的流速。
③由ZnS2O4生成Na2S2O4的化学方程式为_____________。
(3)称取2.0gNa2S2O4样品溶于冷水中,配成100mL吐溶液,取出10mL该溶液于试管中,用0 .10 mol/L的KMnO4溶液滴定(滴定至终点时产物为Na2SO4和MnSO4),重复上述操作2次,平均消耗溶液12.00mL。则该样品中Na2S2O4的质量分数为_______(杂质不参与反应)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com