
| A、标准状况下,2.24L甲醇中含有的分子数为0.1NA |
| B、1L 0.1mol/L Na2CO3溶液中,含有的CO32-数目为0.1NA |
| C、室温下,1.40g乙烯和丁烯的混合气体中含有的碳原子数目为0.1NA |
| D、标准状况下,2.24 L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.2NA |


科目:高中化学 来源: 题型:
| 物质 | X | Y | Z |
| 初始浓度/mol?L-1 | 0.1 | 0.2 | 0 |
| 平衡浓度/mol?L-1 | 0.05 | 0.05 | 0.1 |
| A、反应达到平衡时,Y的转化率为75% |
| B、该反应可表示为X+3Y?2Z,且常温下的平衡常数为1600 |
| C、其它条件不变时,增大压强能使上述平衡向生成Z的方向移动,且平衡常数将增大 |
| D、若升高温度能使该反应的平衡常数减小,说明该反应的正反应为放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、阴极析出7.04g铜 |
| B、阴极电极反应为:Cu2++2e-═Cu;2H++2e-═H2↑ |
| C、阳极电极反应为:4OH--4e-═2H2O+O2↑ |
| D、向电解后的溶液中加入铜最多溶解7.04g铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2molH2(g)和2molI2(g)与4molH2(g)和4molI2(g)分别充入两个恒温恒容的容器中反应达到平衡时H2的转化率 |
| B、物质的量浓度相等的 (NH4)2SO4溶液和 (NH4)2CO3溶液中NH4+的浓度 |
| C、用量筒量取液体时,仰视的读数和俯视的读数 |
| D、物质的量浓度相等的CH3COONa溶液和Na2CO3溶液中水的电离程度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol NH3中含有的电子数为8nA |
| B、22.4L氧气所含的氧原子数为2nA |
| C、常温常压下,18g H2O所含的原子数为3nA |
| D、标准状况下,11.2L Br2中含Br-Br键数为0.5nA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 mol氨基(-NH2)中含电子数为10NA |
| B、标况下,22.4 L N2和NO的混合气体所含的原子数为2NA |
| C、假设1 mol氯化铁完全转化为氢氧化铁胶体,则分散系中胶体微粒数为NA |
| D、在反应CaO+3C=CaC2+CO中,生成1 mol CO,转移的电子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
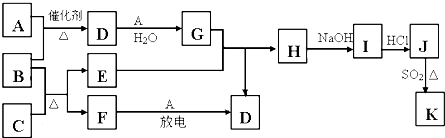
 A~H是中学化学常见的物质,它们之间的转化关系如图所示(部分产物已略去).已知B、D是生活中常见的金属单质,G是气体单质,C的焰色反应呈黄色.
A~H是中学化学常见的物质,它们之间的转化关系如图所示(部分产物已略去).已知B、D是生活中常见的金属单质,G是气体单质,C的焰色反应呈黄色.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com