
分析 将3mol A和2.5mol B混合于2L的密闭容器中,5min后反应达到平衡状态,容器内的压强变小,则3+1>x+2,则x<2,故x=1,平衡时D的平均反应速率为0.1mol/(L•min),则生成D为0.1mol/(L•min)×5min×2L=1mol,则:
3A(g)+B(g)?C(g)+2D(g)
起始量(mol):3 2.5 0 0
转化量(mol):1.5 0.5 0.5 1
平衡量(mol):1.5 2 0.5 1
(1)转化率=$\frac{物质的量变化量}{起始物质的量}$×100%;
(2)恒温恒容下,压强之比等于气体物质的量之比.
解答 解:将3mol A和2.5mol B混合于2L的密闭容器中,5min后反应达到平衡状态,容器内的压强变小,则3+1>x+2,则x<2,故x=1,平衡时D的平均反应速率为0.1mol/(L•min),则生成D为0.1mol/(L•min)×5min×2L=1mol,则:
3A(g)+B(g)?C(g)+2D(g)
起始量(mol):3 2.5 0 0
转化量(mol):1.5 0.5 0.5 1
平衡量(mol):1.5 2 0.5 1
(1)平衡时B转化率=$\frac{0.5mol}{2.5mol}$×100%=20%,故答案为:20%;
(2)恒温恒容下,压强之比等于气体物质的量之比,则平衡时容器内的压强与原容器内压强的比值为(1.5+2+0.5+1)mol:(3+2.5)mol=10:11,故答案为:10:11.
点评 本题考查化学平衡计算,关键是确定C的系数,注意三段式解题法在化学平衡计算中应用.


 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 80% | B. | 65% | C. | 45% | D. | 37% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热化学方程式中的化学计量数只表示物质的量,可以是分数 | |
| B. | △H>0表示放热反应,△H<0表示吸热反应 | |
| C. | 1 mol H2与0.5 mol O2反应放出的热就是H2的燃烧热 | |
| D. | 1 mol H2SO4与1 mol Ba(OH)2反应生成BaSO4沉淀时放出的热叫做中和热 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验小组用如图所示的实验装置进行实验.
实验小组用如图所示的实验装置进行实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有①②④⑤ | B. | 只有③ | C. | 只有②③ | D. | 只有①④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由题给△H值可知,该反应是一个放热反应 | |
| B. | △S>0表明该反应是一个熵增加的反应 | |
| C. | 该反应在室温下可能自发 | |
| D. | 不能确定该反应能否自发进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
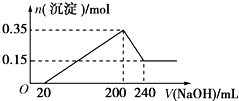 将一定质量的镁铝混合物投入200mL硫酸中,固体全部溶解后,向所得溶液中加入5mol/L的NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V的变化如图所示.
将一定质量的镁铝混合物投入200mL硫酸中,固体全部溶解后,向所得溶液中加入5mol/L的NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V的变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{ρ}{400}$ | B. | $\frac{20}{ρ}$ | C. | 2.5 ρ | D. | 1.25 ρ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com