
已知:2SO2(g)+O2(g) 2SO3(g)ΔH="-197" kJ·mol-1。实验测得4 mol SO2参加上述反应放出354 kJ热量,则SO2的转化率最接近于( )
2SO3(g)ΔH="-197" kJ·mol-1。实验测得4 mol SO2参加上述反应放出354 kJ热量,则SO2的转化率最接近于( )
| A.90% | B.80% | C.50% | D.40% |
科目:高中化学 来源: 题型:单选题
25℃、101kPa下,碳、氢气和甲烷的燃烧热依次是393.5 kJ·mol—1、285.8 kJ·mol—1
和890.3kJ·mol—1,下列选项中正确的是
| A.2H2(g)+O2(g)=2H2O(l)△H=—285.8kJ·mol—1 |
| B.CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=+890.3kJ·mol—1 |
| C.H2(g)+1/2O2(g)=H2O(g)△H<—285.8kJ·mol—1 |
| D.C(s)+2H2(g)=CH4(g)△H=—74.8 kJ·mol—1 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
肼(N2 H4)是一种可用于火箭或原电池的燃料。已知:
N2(g)+2O2(g)=2NO2(g) △H=+67.7 kJ/mol ①
N2 H4(g)+O2(g)=N2(g)+2H3O(g) △H=-534 kJ/mol ②
下列说法正确的是
| A.反应①中反应物所具有的总能量大于生成物所具有的总能量 |
| B.2N2 H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1000.3 kJ/mol |
| C.铂作电极,KOH溶液作电解质溶液,由反应②设计的燃料电池,其负极反应式为N2H4-4e-+4OH-=N2+4H2O |
| D.铂作电极,KOH溶液作电解质溶液,由反应②设计的燃料电池,工作一段时间后,KOH溶液的pH将增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在298 K、1.01×105 Pa下,将32 g SO2通入750 mL 1 mol/L KOH溶液中充分反应。测得反应放出x kJ的热量。已知在该条件下,1 mol SO2通入1 L 2 mol/L KOH溶液中充分反应放出y kJ的热量。则SO2与KOH溶液反应生成KHSO3的热化学方程式正确的是( )
| A.SO2(g)+KOH(aq)=KHSO3(aq)ΔH="-(4x-y)" kJ/mol |
| B.SO2(g)+KOH(aq)=KHSO3(aq)ΔH="-(2x-y)" kJ/mol |
| C.SO2(g)+KOH(aq)=KHSO3(aq)ΔH="-(2y-x)" kJ/mol |
| D.2SO2(g)+2KOH(l)=2KHSO3(l)ΔH="-(8x-2y)" kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知:P4(g)+6Cl2(g)=4PCl3(g) ΔH=a kJ·mol-1,P4(g)+10Cl2(g)=4PCl5(g) ΔH=b kJ·mol-1,并知形成或拆开1 mol化学键放出或吸收的能量称为该化学键的键能。P4具有正四面体结构,PCl5中P-Cl键的键能为c kJ·mol-1,PCl3中P-Cl键的键能为1.2c kJ·mol-1。下列叙述正确的是( )
| A.P-P键的键能大于P-Cl键的键能 |
| B.可求Cl2(g)+PCl3(g)=PCl5(s)的反应热ΔH |
| C.Cl-Cl键的键能为(b-a+5.6c)/4 kJ·mol-1 |
| D.P-P键的键能为(5a-3b+12c)/8 kJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应A,可实现氯的循环利用。
反应A:4HCl+O2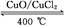 2Cl2+2H2O
2Cl2+2H2O
已知:Ⅰ.反应A中,4 mol HCl被氧化,放出115.6 kJ的热量。
Ⅱ.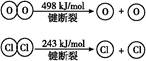
判断下列说法正确的是( )
| A.反应A的ΔH>-115.6 kJ/mol |
| B.断开1 mol H—O键与断开1 mol H—Cl键所需能量相差约为32 kJ |
| C.H2O中H—O键比HCl中H—Cl键弱 |
| D.由Ⅱ中的数据判断氯元素的非金属性比氧元素强 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知:HCN(aq)与NaOH(aq)反应的ΔH=-12.1 kJ·mol-1;HCl(aq)与NaOH(aq)反应的ΔH=-57.3 kJ·mol-1,则HCN在水溶液中电离的ΔH等于 ( )。
| A.-69.4 kJ·mol-1 | B.-45.2 kJ·mol-1 |
| C.+45.2 kJ·mol-1 | D.+69.4 kJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
25 ℃、101 kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5 kJ·mol-1、285.8 kJ·mol-1、890.3 kJ·mol-1、2 800 kJ·mol-1,则下列热化学方程式正确的是( )。
A.C(s)+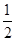 O2(g)=CO(g)ΔH=-393.5 kJ·mol-1 O2(g)=CO(g)ΔH=-393.5 kJ·mol-1 |
| B.2H2(g)+O2(g)=2H2O(g)ΔH=+571.6 kJ·mol-1 |
| C.CH4(g)+2O2(g)=CO2(g)+2H2O(g)ΔH=-890.3 kJ·mol-1 |
D.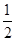 C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l)ΔH=-1 400 kJ·mol-1 C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l)ΔH=-1 400 kJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列图示与对应的叙述相符的是( )。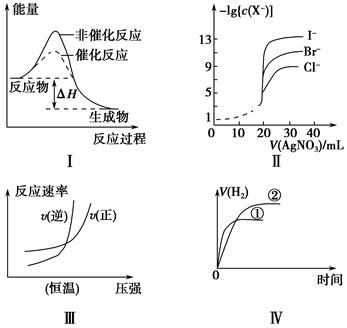
| A.图Ⅰ中ΔH表示某一反应有无催化剂的反应热相同 |
| B.用0.010 0 mol·L-1硝酸银标准溶液,滴定浓度均为0.100 0 mol·L-1 Cl-、Br-及I-的混合溶液,由图Ⅱ曲线,可确定首先沉淀的是Cl- |
| C.图Ⅲ可表示工业合成氨反应在温度一定的情况下反应速率与压强的关系 |
| D.图Ⅳ表示相同体积、相同pH的一元强酸溶液①和一元弱酸溶液②分别与足量的锌粉发生反应,V(H2)随时间的变化曲线 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com