
| A. | c(H+)=c(OH-)的溶液中:SO42-、Na+、Cl-、Fe3+ | |
| B. | 在c(HCO3-)=0.1mol•L-1的溶液中:[Al(OH)4]-、Na+、NO3-、C6H5O- | |
| C. | 饱和氯水中:K+、Mg2+、CH3COO-、SO42- | |
| D. | 能使酚酞变红的溶液:Ba2+、NO3-、I-、Na+ |
分析 A.中性溶液中不能大量存在Fe3+;
B.[Al(OH)4]-促进HCO3-的电离;
C.饱和氯水中含氢离子;
D.能使酚酞变红的溶液,显碱性.
解答 解:A.Fe3+在pH为4.4左右沉淀完全,则c(H+)=c(OH-)的中性溶液中不能大量存在Fe3+,故A错误;
B.[Al(OH)4]-促进HCO3-的电离,则不能大量共存,故B错误;
C.饱和氯水中含氢离子,不能大量存在CH3COO-,故C错误;
D.能使酚酞变红的溶液,显碱性,该组离子之间不反应,可大量共存,故D正确;
故选D.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应、促进电离的离子反应考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 氧化产物为Fe3O4和SiO2 | |
| B. | 氧化剂与还原剂物质的量的之比为2:3 | |
| C. | 当有1.5mol Fe2SiO4参加反应时,转移的电子为3 mol | |
| D. | 当有1mol CO2参加反应时,被氧化的Fe2SiO4的物质的量为1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
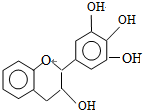
| A. | 分子式为C15H12O5 | |
| B. | 1molEGC与5molNaOH恰好完全反应 | |
| C. | 易发生氧化反应和取代反应,不能发生消去反应 | |
| D. | 遇FeCl3溶液能发生显色反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容器内混合气体的密度不随时间的变化而变化 | |
| B. | 单位时间内每消耗3mol H2,同时生成2mol NH3 | |
| C. | 混合气体的总质量不随时间的变化而变化 | |
| D. | 混合气体的总物质的量不随时间的变化而变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
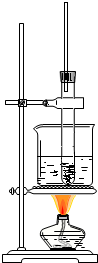 硝基苯是制造染料的重要原料.某同学在实验室里用右图装置制取硝基苯,主要步骤如下:
硝基苯是制造染料的重要原料.某同学在实验室里用右图装置制取硝基苯,主要步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1的NaHSO3溶液与0.2 mol•L-1的NaClO溶液等体积混合:HSO3-+ClO-=SO42-+Cl-+H+ | |
| B. | 等浓度的Fe2(SO4)3溶液和Ba(OH)2溶液混合:2Fe3++3SO42-+3Ba2++6OH-=2Fe(OH)3↓+3BaSO4↓ | |
| C. | Ca(HCO3)2溶液与少量NaOH溶液反应:2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+2H2O | |
| D. | H218O中投入过氧化钠:2H218O+2Na2O2=4Na++4OH-+18O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 电负性 离子半径 键的极性 | 熔点 |
| N<O O2->Al3+ C-H<H-O | Al<Al2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
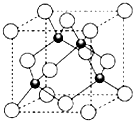 X、Y、Z三元素的原子序数依次增大,三原子的核外最外层电子排布均为4s1.
X、Y、Z三元素的原子序数依次增大,三原子的核外最外层电子排布均为4s1.| r(Zn2+) | r(Z+) | r(S2-) | r(Cl-) | 熔点 | |
| ZnS | ZCl | ||||
| 74pm | 77pm | 184pm | 181pm | 1700℃ | 430℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
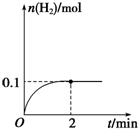 一定温度下,向1L密闭容器中加入1mol HI(g),发生反应2HI?H2+I2,H2物质的量随时间的变化如图所示.
一定温度下,向1L密闭容器中加入1mol HI(g),发生反应2HI?H2+I2,H2物质的量随时间的变化如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com