
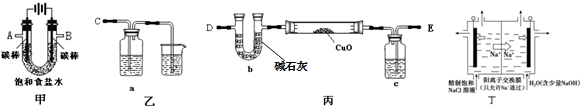
分析 (1)在电解池的阴极上产生的是氢气,阳极上产生的是氯气,据实验目的来连接装置;
(2)氯气具有氧化性,能使湿润的淀粉碘化钾试纸变蓝;电解饱和食盐水,阳极生成氯气,阴极生成氢气,据此写出电解的离子方程式;
(3)电解饱和食盐水产生的氢气中含有水蒸气,会影响铜的相对原子质量的测定,必须干燥;
(4)根据电解饱和食盐水的方程式:利用公式c=$\frac{n}{V}$来计算NaOH的物质的量浓度,然后求出氢离子的浓度,最后求出pH;
(5)①由题意可知,氯离子放电生成ClO2,由元素守恒可知,有水参加反应,同时生成氢离子;
②在阴极发生2H++2e-=H2↑,通过阳离子交换膜的阳离子为+1价离子,根据n=$\frac{V}{{V}_{m}}$计算氢气的物质的量,根据电子转移守恒计算阳离子的物质的量.
解答 解:(1)A是阴极,阴极上产生的是氢气,B是阳极,阳极上产生的是氯气,要用氢气来还还原氧化铜,所以A连接E,干燥氢气后用氢气来还原氧化铜,所以B连接C,
故答案为:E;C;
(2)氯气具有氧化性,能使湿润的淀粉碘化钾试纸变蓝,可以用湿润的淀粉碘化钾试纸来检验;电解饱和食盐水生成氯气、氢气和氢氧化钠,电解的离子方程式为:2Cl-+2H2O $\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH-,
故答案为:淀粉KI溶液;2Cl-+2H2O $\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH-;
(3)氢气的干燥可以用浓硫酸,在实验时,如果氢气中有水,会将硬质玻璃管炸裂,
故答案为:浓硫酸;吸收氢气中的水,防止硬质玻璃管炸裂;
(4)通过以上分析知,反应物是氯化钠和水,产物是氯气、氢气、氢氧化钠,反应的方程式为:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2NaOH,当产生的H2的体积为8.4mL即0.000375mol时,生成氢氧化钠的物质的量为0.00075mol,所以溶液中NaOH的物质的量浓度=$\frac{0.00075mol}{0.075L}$═0.01mol/L,所以氢离子的浓度为:$\frac{1×1{0}^{-14}}{0.01}$=1×10-12mol/L,该溶液的pH=12,
故答案为:12;
(5)①由题意可知,氯离子放电生成ClO2,由元素守恒可知,有水参加反应,同时生成氢离子,电极反应式为:Cl--5e-+2H2O=ClO2↑+4H+,
故答案为:Cl--5e-+2H2O=ClO2↑+4H+;
②在阴极发生2H++2e-=H2↑,氢气的物质的量为:$\frac{0.112L}{22.4L/mol}$=0.005mol,通过阳离子交换膜的阳离子为+1价离子,故交换膜的阳离子的物质的量为:0.005mol×2=0.01mol,
故答案为:0.01.
点评 本题考查相对分子质量的测定及电解原理,题目难度中等,明确实验目的、实验原理为解答关键,电解反应是难点、易错点,是对学生综合能力的考查,需要学生具有扎实的基础与分析解决问题的能力.


 华东师大版一课一练系列答案
华东师大版一课一练系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2v正(B)=v逆(C) | B. | 该体系的密度都不随时间变化 | ||
| C. | 1molA断裂,同时1molC也断裂 | D. | 该体系的温度不随时间而变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | 反应温度/℃ | c(H2O2)/mol•L-1 | V(H2O2)/mL | m(MnO2)/g | t/min |
| 1 | 20 | 2 | 10 | 0 | t1 |
| 2 | 20 | 2 | 10 | 0.1 | t2 |
| 3 | 20 | 4 | 10 | 0.1 | t3 |
| 4 | 40 | 2 | 10 | 0.1 | t4 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
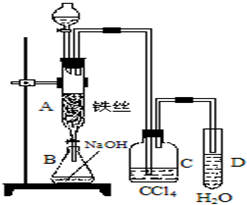 某化学课外小组用如图装置制取溴苯.先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中.
某化学课外小组用如图装置制取溴苯.先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com